«Коррозия: материалы, защита» — ежемесячный рецензируемый научно-технический, производственный и учебно-методический журнал выпускается с 2003 г. ООО «Наука и технологии».
Журнал рекомендован ВАК для публикации результатов диссертаций на соискание ученых степеней кандидата и доктора наук по специальности «Технологии электрохимических процессов и защита от коррозии» (см. на сайте http://www.elibrary.ru).
Журнал содержит информацию о новейших достижениях коррозионной науки и методах борьбы с коррозией в атомной, авиационной, автомобильной, машиностроительной, металлургической, нефтегазодобывающей, нефтехимической и других отраслях промышленности, в энергетике, строительстве, коммунальном хозяйстве, на железнодорожном и морском транспорте и т.д.
Основные тематические разделы журнала:
- общие вопросы коррозии
- отраслевые проблемы коррозии
- высокотемпературная коррозия
- коррозионное растрескивание и усталость металлов и сплавов
- электрохимическая коррозия
- ингибиторы коррозии
- микробиологическая коррозия
- защитные металлические покрытия
- конверсионные покрытия
- полимерные и лакокрасочные покрытия
- неметаллические коррозионно-стойкие материалы
- методы исследования и коррозионный мониторинг
- коррозия в быту
Редакция надеется, что журнал окажет информационную поддержку специалистам предприятий в организации противокоррозионной защиты, в модернизации уже существующих технологий и средств, а также в обмене опытом между специалистами различных отраслей промышленности.
Приглашаем к сотрудничеству всех заинтересованных специалистов. Плата за публикацию статей с авторов не взимается.
Журнал «Коррозия: металлы, защита» с января 2007 г. переводится на английский язык и выпускается издательством “Pleiades Publishing, Ltd.” в виде отдельных сборников статей как приложение к журналу «Protection of Metals and Physical Chemistry of Surfaces», распространение которого осуществляет издательство “Springer”.
Переводная версия журнала входит в международные реферативные базы данных систем цитирования (индексирования): Academic OneFile, Academic Search, CSA, ChemWeb, Chemical Abstracts Service (CAS), Computing and Technology, Current Contents/Engineering, EBSCO, EI- Compendex, Earthquake Engineering Abstracts, Gale, Google Scholar, INIS Atomindex, INSPEC, Journal Citation Reports/Science Edition, OCLC, ProQuest, SCImago, SCOPUS, Science Citation Index Expanded (SciSearch), Summon by Serial Solutions.
Русскоязычная версия журнала включена в базу Russian Science Citation Index (RSCI) на платформе Web of Science.
ВНИМАНИЕ!
Издательство ООО “Наука и технологии» доводит до сведения авторов, что статьи принимаются к публикации в журнале при условии передачи издательству ИСКЛЮЧИТЕЛЬНОГО права. Указанное положение обусловлено требованием соблюдения оригинальности статьи, что имеет принципиальное значение для англоязычной версии журнала.
Главный редактор — Цивадзе Аслан Юсупович, академик РАН
Заместитель главного редактора — Кузнецов Юрий Игоревич, д-р хим. наук, проф.
Ответственный секретарь — Семилетов Алексей Михайлович, канд. хим. наук
Основные разделы журнала:
- Общие вопросы коррозии
- Отраслевые проблемы коррозии
- Ингибиторы коррозии
- Защитные покрытия
- Композиционные материалы
- Коррозия неметаллических материалов
- Методы исследования и коррозионный мониторинг
- Информация
- Микробная коррозия
- Коррозия в быту
- История коррозионных исследований
- Лакокрасочные покрытия
- Информационные продукты и услуги
- Полимерные и лакокрасочные покрытия
- Микробиологическая коррозия
- Из истории коррозионных исследований
- Коррозия в процессах водородной энергетики
- Конверсионные покрытия
- ЕВРОКОРР-2010
- Международная конференция «Фундаментальные аспекты коррозионного материаловедения и защиты металлов от коррозии» памяти Г.В. Акимова
- Пленарные лекции
- Коррозия металлов и сплавов
- Коррозионное растрескивание
- КОРРОЗИЯ НЕМЕТАЛЛИЧЕСКИХ И КОМПОЗИЦИОННЫХ МАТЕРИАЛОВ
- МЕТОДЫ ЗАЩИТЫ ОТ КОРРОЗИИ И КОРРОЗИОННЫЙ МОНИТОРИНГ
- Обзорные статьи
- Хроника
- Коррозия и старение неметаллических материалов
—> Редакционная коллегия:
Авдеев Ярослав Геннадиевич, д-р хим. наук, Институт физической химии имени А.Н. Фрумкина РАН
Алцыбеева Алла Ивановна, д-р техн. наук, проф., заслуженный деятель науки РФ
Андреев Николай Николаевич, д-р хим. наук, заведующий Лабораторией окисления и пассивации металлов и сплавов, Федеральное государственное бюджетное учреждение науки Институт физической химии и электрохимии имени А. Н. Фрумкина РАН
Банных Олег Александрович, академик РАН, проф. заведующий Лабораторией конструкционных сталей и сплавов им. академика Н.Т. Гудцова, Федеральное государственное бюджетное учреждение науки Институт металлургии и материаловедения им. А.А. Байкова РАН
Бережная Александра Григорьевна, д-р хим. наук, проф., заведующий Кафедрой электрохимии химического факультета, Федеральное государственное автономное образовательное учреждение высшего профессионального образования «Южный федеральный университет»
Бурлов Владислав Васильевич, д-р техн. наук, проф., генеральный директор ООО НПО «НЕФТЕХИМ»
Ваграмян Тигран Ашотович, д-р техн. наук, проф., заведующий Кафедрой материаловедения и защиты от коррозии, Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Российский химико-технологический университет имени Д. И. Менделеева»
Головин Владимир Анатольевич, д-р техн. наук, заведующий Лабораторией защиты от коррозии металлов и сплавов в сильноагрессивных средах, Федеральное государственное бюджетное учреждение науки Институт физической химии и электрохимии имени А. Н. Фрумкина РАН
Золотов Юрий Александрович, академик РАН, проф., заведующий Кафедрой аналитической химии, Химический факультет, Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Московский государственный университет имени М. В. Ломоносова»
Каблов Евгений Николаевич, академик РАН, проф., Генеральный директор, Федеральное государственное унитарное предприятие «Всероссийский научно-исследовательский институт авиационных материалов» Государственный научный центр Российской Федерации
Карпов Валерий Анатольевич, д-р техн. наук, заместитель директора по научной работе, Федеральное государственное бюджетное учреждение науки
Институт проблем экологии и эволюции им. А.Н. Северцова
РАН
Леонтьев Леопольд Игоревич, академик РАН, руководитель Управления земельно-имущественного комплекса РАН, Президиум Российской академии наук, Аппарат Президиума Российской академии наук
Маршаков Андрей Игоревич, д-р хим. наук, заведующий Лабораторией коррозии металлов в природных условиях, Федеральное государственное бюджетное учреждение науки Институт физической химии и электрохимии имени А. Н. Фрумкина РАН
Олейник Сергей Валентинович, канд. хим. наук, заведующий Лабораторией высокотемпературных коррозионных испытаний в водных средах, Федеральное государственное бюджетное учреждение науки Институт физической химии и электрохимии имени А. Н. Фрумкина РАН
Решетников Сергей Максимович, д-р хим. наук, проф., директор Научно-образовательного центра «Физикохимия и технология наноматериалов», Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Удмуртский государственный университет»
Сергиенко Валентин Иванович, академик РАН, проф., директор, Федеральное государственное бюджетное учреждение науки Институт химии Дальневосточного отделения РАН
Степанова Валентина Федоровна, академик Российской инженерной академии (РИА), проф., Почетный строитель России, заведующий Лабораторией коррозии и долговечности бетонных и железобетонных конструкций, Научно-исследовательский институт бетона и железобетона (НИИЖБ)
Таранцева Клара Рустемовна, д-р техн. наук, проф., проректор по научной работе Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Пензенский государственный технологический университет»
Томин Виктор Петрович, д-р техн. наук, проф., заместитель технического директора по качеству – начальник ИЦ УКК, ОАО «Ангарская нефтехимическая компания», Испытательный центр
Шеин Анатолий Борисович, д-р хим. наук, проф., заведующий Кафедрой физической химии, Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Пермский государственный национальный исследовательский университет»
Щербаков Александр Иванович, д-р хим. наук, заведующий Лабораторией коррозии металлов и сплавов, Федеральное государственное бюджетное учреждение науки Институт физической химии и электрохимии имени А. Н. Фрумкина РАН
Адрес для почтовых отправлений: 105215, г.Москва, 9-я Парковая ул., дом 60, ООО»Наука и технологии».
Защита металлических изделий от коррозии

Вопросы, рассмотренные в материале:
- Почему важна защита металлических изделий от коррозии
- Какие виды коррозии существуют
- Какие есть способы защиты металлических изделий от коррозии
Человек с глубокой древности использует предметы из металлов. До сих пор они остаются важной составляющей нашей жизни, причем самыми востребованными являются изделия из железа и его сплавов. Однако все они имеют один серьезный минус, а именно подверженность коррозии, то есть способность разрушаться в процессе окисления. Своевременная защита металлических изделий от коррозии дает возможность увеличить их срок службы.
Почему так важна защита металлических изделий от коррозии

Коррозия оказывает негативное электрохимическое, химическое воздействие на целостность поверхности предметов из стали, чугуна. В результате происходит разъедание металлических изделий, они портятся и не могут использоваться по назначению.
По статистике экспертов, каждый год примерно 10 % от объема всех добываемых на планете металлов приходится расходовать на устранение потерь, вызванных коррозией. Ведь последняя приводит к полной утрате металлическими предметами своих эксплуатационных свойств.
Как только на изделиях из чугуна или стали появляются признаки коррозии, у них снижается герметичность, прочность. Параллельно падает их способность проводить тепло, пластичность, отражательный потенциал, иными словами, утрачивается целый ряд немаловажных свойств. Все это приводит к тому, что конструкции оказываются непригодны для использования по назначению. Вот почему так важно грамотно и своевременно применять существующие способы защиты металлических изделий от коррозии, о которых далее пойдет речь.
Основные виды коррозии

Прежде чем приступать к защите металлических изделий от коррозии, важно понять природу этого процесса. Принято выделять такие типы коррозии:
- Атмосферная. Причиной окисления становится контакт металлического предмета с кислородом и содержащимися в воздухе водяными парами. Ржавчина образуется быстрее, когда в воздухе присутствуют загрязнения в виде химически активных веществ.
- Жидкостная. Формируется на металлических предметах, находящихся в водной среде. Если речь идет о морской воде, то в ней окисление значительно ускоряется за счет содержащегося в жидкости большого объема солей.
- Почвенная. Данному типу подвержены металлические изделия, конструкции, находящиеся в грунте. Химические реакции запускаются и протекают под действием химических элементов, входящих в состав грунта, грунтовых вод, разного рода утечек.
Коррозия на металлических изделиях может проявляться по-разному:
- формируется сплошной ржавый слой или его отдельные фрагменты;
- появляются небольшие участки ржавчины, проникающей внутрь детали;
- образуются глубокие трещины;
- окисляется один из компонентов сплава;
- происходит глубинное проникновение по всему объему;
- сочетаются сразу несколько симптомов.
Причины возникновения могут иметь природу двух видов:
- Химическую, то есть металл разрушается в результате химических реакций с активными веществами.
- Электрохимическую, связанную с тем, что при контакте с электролитическими растворами возникает электрический ток, под его действием замещаются электроны металлов. Это приводит к тому, что страдает кристаллическая структура, образуется ржавчина.
Способы защиты металлических изделий от коррозии
Можно выделить несколько основных способов защиты металлических изделий от коррозии:
- легирование металлов;
- защитные покрытия (металлические, неметаллические);
- электрохимическая защита;
- изменение свойств коррозионной среды;
- рациональное конструирование изделий.

1. Легирование металлов.
Это один из действительно эффективных способов, позволяющих увеличить стойкость металлов к ржавчине. В процессе легирования в состав сплава или металла вносят легирующие элементы, такие как хром, никель, молибден, пр. Они приводят к пассивации металла, то есть металл или сплав переходит в состояние повышенной коррозионной устойчивости за счет торможения анодного процесса. Пассивное состояние металла достигается благодаря тому, что на его поверхности формируется совершенная по структуре оксидная пленка. Она обеспечивает защиту изделия лишь при условии, что кристаллические решетки металла и образующегося оксида имеют между собой максимальное сходство.
Рекомендовано к прочтению
Легирование активно используется для защиты, например, закладных деталей от коррозии. Такую обработку проводят для железа, алюминия, меди, магния, цинка и сплавов на их основе. Получившиеся сплавы, по сравнению с исходными металлами, отличаются повышенной коррозионной стойкостью, а также жаростойкостью и жаропрочностью.
Жаростойкость – способность металла сохранять свои свойства даже при высоких температурах, когда повышается вероятность газовой коррозии.
Жаропрочность – сохранение конструкционным материалом высокой механической прочности при значительном повышении температуры. Этого свойства обычно достигают легированием металлов и сплавов. Так, сталь легируется хромом, алюминием и кремнием. При высоких температурах они окисляются первыми, в результате чего формируются плотные защитные оксидные пленки, например Al2O3 и Cr2O3.
Кроме того, легирование позволяет снизить скорость электрохимической коррозии, особенно когда она сопровождается выделением водорода. Ярким примером коррозионностойких сплавов являются нержавеющие стали, где роль легирующих компонентов играют хром, никель и ряд прочих металлов.
2. Защитные покрытия.

В этом случае на поверхности металлического изделия искусственно формируются дополнительные слои для защиты. На самом деле, этот подход является наиболее распространенным среди существующих способов борьбы с коррозией. Мало того, что подобные покрытия оберегают предмет от появления ржавчины, они придают поверхностям ценные физико-химические характеристики. Речь идет об износостойкости, электрической проводимости и еще ряде свойств. Такие покрытия могут быть металлическими и неметаллическими. Однако, вне зависимости от состава, к ним предъявляются единые требования: хорошие адгезионные качества, сплошность и способность сохранять свои свойства в агрессивной среде.
Металлические покрытия выделяются на фоне других способов защиты металлических изделий от коррозии тем, что обладают неоднозначным действием. Пока защитный слой сохраняет свою целостность, он изолирует поверхность изделия от воздействия окружающей среды. То есть по своему действию близок к любой механической обработке, например, окраске, оксидной пленке, пр. В целом, металлические покрытия не должны пропускать коррозионные агенты.
Если такое покрытие повреждается либо в нем есть поры, образуется гальванический элемент. Нужно понимать, что характер коррозионного разрушения материала во многом зависит от электрохимических характеристик обоих металлов. Защитные антикоррозионные покрытия бывают катодными или анодными. В число первых входят покрытия, потенциалы которых в данной среде являются более положительными, чем у основного металла. Анодные покрытия обладают наиболее отрицательным потенциалом, чем потенциал материала изделия.
Если повреждается никелевое покрытие, на анодных участках железо окисляется за счет образования микрокоррозионных гальванических элементов. На катодных участках происходит восстановление водорода. Таким образом, катодные покрытия обеспечивают защиту металлических изделий от коррозии только при условии, что в покрытии нет пор и повреждений.
Если в цинковом слое появляется местное повреждение, защита продолжит разрушаться, но поверхность железа не пострадает от коррозии. На анодных участках происходит процесс окисления цинка, а на катодных участках – восстановление водорода.
Электродные потенциалы металлов зависят от компонентов и их доли в растворах, поэтому характер используемого для защиты покрытия может быть изменен за счет изменения состава.

Защита деталей от коррозии горячим методом осуществляется при помощи разных металлов и подходов. Сформировать металлические защитные покрытия позволяют несколько способов: электрохимический (гальванические покрытия); погружение в расплавленный металл (горячее цинкование, лужение); металлизация (нанесение расплавленного металла на защищаемую поверхность струей сжатого воздуха); химический (защита изделия посредством восстановителей, таких как гидразин).
Материалами для металлических защитных покрытий могут быть как чистые металлы (цинк, кадмий, алюминий, никель, медь, хром, серебро и др.), так и их сплавы (бронза, латунь и др.).
Неметаллические защитные покрытия делятся на неорганические и органические. Суть такой обработки состоит преимущественно в изоляции металла от окружающей среды.
Для защиты металлических изделий от коррозии неметаллическими покрытиями используют неорганические эмали, оксиды металлов, соединение хрома, фосфора, пр. В число органических входят лакокрасочные покрытия, смолы, пластмассы, полимерные пленки, резина.
По своему составу неорганические эмали являются силикатами, иначе говоря, это соединения кремния. Нужно понимать, что подобные покрытия хрупкие и растрескиваются из-за тепловых и механических ударов.
Лакокрасочные покрытия встречаются более часто. Главные условия для защиты металлических изделий от коррозии с помощью лакокрасочных покрытий: покрытие должно быть сплошным, газо- и водонепроницаемым, химически стойким, эластичным, обладать высоким сцеплением с материалом, механической прочностью, твердостью.
3. Химические способы.
Существует множество методов защиты металла, относящихся к этой группе. Одним из них является обработка поверхности веществами, вступающими с ней в химическую реакцию, в результате чего формируется пленка устойчивого химического соединения. Речь идет о таких способах как оксидирование, фосфатирование, сульфидирование, пр.
Оксидирование представляет собой способ защиты за счет образования оксидных пленок на поверхности металлических изделий.
Наиболее современным вариантом этого метода является химическая и электрохимическая обработка деталей в щелочных растворах.

Для железа и его сплавов наиболее часто используется щелочное оксидирование в растворе, содержащем NaOH, NaNO3, NaNO2 при температуре +135…+140 °С. Оксидирование черных металлов называется воронением.
Фосфатирование является методом формирования фосфатных пленок на изделиях из цветных и черных металлов. Для фосфатирования металлическое изделие погружают в растворы фосфорной кислоты и ее кислых солей (H3PO4 + Mn(H2PO4)2) при температуре +96…+98 °С.
Фосфатная пленка оказывается химически связана с материалом изделия и состоит из сросшихся между собой кристаллов, разделенных порами ультрамикроскопических размеров. Главными достоинствами фосфатных пленок являются хорошая адгезия и развитая шероховатая поверхность. Благодаря этому, такие пленки становятся отличной основой для лакокрасочных покрытий и пропитывающих смазок. Обычно данный подход выбирают для защиты деталей от коррозии, когда те будут использоваться в закрытых помещениях, либо если изделие подвергнется последующей окраске или покрытию лаком. Однако у таких пленок есть свои минусы, в первую очередь к ним относятся низкая прочность и эластичность, хрупкость.
Анодированием называется защита поверхности металла при помощи формирования оксидных пленок, обычно данный способ используется для защиты алюминия. На поверхности этого металла всегда есть тонкая оксидная пленка Al2O3 или Al2O3 ×∙(H2O)n. Однако она не способна противостоять появлению ржавчины, поэтому в результате воздействия окружающей среды на алюминии постепенно образуется слой продуктов коррозии.
Для искусственного формирования оксидных пленок используют химический и электрохимический способы. Во втором случае алюминиевое изделие используется в качестве анода электролизера. Тогда как роль электролита играет раствор серной, ортофосфорной, хромовой, борной или щавелевой кислот. Катодом может быть металл, не вступающий в реакцию с раствором электролита, допустим, нержавеющая сталь. На катоде выделяется водород, за счет чего на аноде формируется оксид алюминия.
От точного выполнения при защите деталей от коррозии требований ГОСТа зависят надежность, сроки эксплуатации изделий. Не менее важно правильно выбрать метод обработки, принимая во внимание условия эксплуатации изделий, а также их изначальные характеристики. В результате удастся обеспечить надежную защиту от ржавчины, а изделие сможет служить значительно дольше, при этом использоваться по своему прямому назначению.
Почему следует обращаться именно к нам
Мы с уважением относимся ко всем клиентам и одинаково скрупулезно выполняем задания любого объема.
Наши производственные мощности позволяют обрабатывать различные материалы:
- цветные металлы;
- чугун;
- нержавеющую сталь.
При выполнении заказа наши специалисты применяют все известные способы механической обработки металла. Современное оборудование последнего поколения дает возможность добиваться максимального соответствия изначальным чертежам.
Для того чтобы приблизить заготовку к предъявленному заказчиком эскизу, наши специалисты используют универсальное оборудование, предназначенное для ювелирной заточки инструмента для особо сложных операций. В наших производственных цехах металл становится пластичным материалом, из которого можно выполнить любую заготовку.
Преимуществом обращения к нашим специалистам является соблюдение ими ГОСТа и всех технологических нормативов. На каждом этапе работы ведется жесткий контроль качества, поэтому мы гарантируем клиентам добросовестно выполненный продукт.
Благодаря опыту наших мастеров на выходе получается образцовое изделие, отвечающее самым взыскательным требованиям. При этом мы отталкиваемся от мощной материальной базы и ориентируемся на инновационные технологические наработки.
Мы работаем с заказчиками со всех регионов России. Если вы хотите сделать заказ на металлообработку, наши менеджеры готовы выслушать все условия. В случае необходимости клиенту предоставляется бесплатная профильная консультация.
Защита металла от коррозии
Металлы используются человеком с доисторических времен, изделия из них широко распространены в нашей жизни. Самым распространенным металлом является железо и его сплавы. К сожалению, они подвержены коррозии, или ржавлению — разрушению в результате окисления. Своевременная защита от коррозии позволяет продлить срок службы металлических изделий и конструкций.

Виды коррозии
Ученые давно борются с коррозией и выделили несколько основных ее типов:
- Атмосферная. Происходит окисление вследствие контакта с кислородом воздуха и содержащимися в нем водяными парами. Присутствие в воздухе загрязнений в виде химически активных веществ ускоряет ржавление.
- Жидкостная. Проходит в водной среде, соли, содержащиеся в воде, особенно морской, многократно ускоряют окисление.
- Почвенная. Этому виду подвержены изделия и конструкции, находящиеся в грунте. Химический состав грунта, грунтовые воды и токи утечки создают особую среду для развития химических процессов.
Исходя из того, в какой среде будет эксплуатироваться изделие, подбираются подходящие методы защиты от коррозии.
Характерные типы поражения ржавчиной
Различают следующие характерные виды поражения коррозией:
- Поверхность покрыта сплошным ржавым слоем или отдельными кусками.
- На детали возникли небольшие участки ржавчины, проникающей в толщину детали.
- В виде глубоких трещин.
- В сплаве окисляется один из компонентов.
- Глубинное проникновение по всему объему.
- Комбинированные.

Виды коррозионных разрушений
По причине возникновения разделяют также:
- Химическую. Химические реакции с активными веществами.
- Электрохимическую. При контакте с электролитическими растворами возникает электрический ток, под действием которого замещаются электроны металлов, и происходит разрушение кристаллической структуры с образованием ржавчины.
Коррозия металла и способы защиты от нее
Ученые и инженеры разработали множество способов защиты металлических конструкций от коррозии.
Защита от коррозии индустриальных и строительных конструкций, различных видов транспорта осуществляется промышленными способами.
Зачастую они достаточно сложные и дорогостоящие. Для защиты металлических изделий в условиях домовладений применяют бытовые методы, более доступные по цене и не связанные со сложными технологиями.
Промышленные
Промышленные методы защиты металлических изделий подразделяются на ряд направлений:
- Пассивация. При выплавке стали в ее состав добавляют легирующие присадки, такие, как Cr, Mo, Nb, Ni. Они способствуют образованию на поверхности детали прочной и химически стойкой пленки окислов, препятствующей доступу агрессивных газов и жидкостей к железу.
- Защитное металлическое покрытие. На поверхность изделия наносят тонкий слой другого металлического элемента — Zn , Al, Co и др. Этот слой защищает железо о т ржавления.
- Электрозащита. Рядом с защищаемой деталью размещают пластины из другого металлического элемента или сплава, так называемые аноды. Токи в электролите текут через эти пластины, а не через деталь. Так защищают подводные детали морского транспорта и буровых платформ.
- Ингибиторы. Специальные вещества, замедляющие или вовсе останавливающие химические реакции.
- Защитное лакокрасочное покрытие.
- Термообработка.

Порошковая покраска для защиты от коррозии
Способы защиты от коррозии, используемые в индустрии, весьма разнообразны. Выбор конкретного метода борьбы с коррозией зависит от условий эксплуатации защищаемой конструкции.
Бытовые
Бытовые методы защиты металлов от коррозии сводятся, как правило, к нанесению защитных лакокрасочных покрытий. Состав их может быть самый разнообразный, включая:
- силиконовые смолы;
- полимерные материалы;
- ингибиторы;
- мелкие металлические опилки.
Отдельной группой стоят преобразователи ржавчины — составы, которые наносят на уже затронутые коррозией конструкции. Они восстанавливают железо из окислов и предотвращают повторную коррозию. Преобразователи делятся на следующие виды:
- Грунты. Наносятся на зачищенную поверхность, обладают высокой адгезией. Содержат в своем составе ингибирующие вещества, позволяют экономить финишную краску.
- Стабилизаторы. Преобразуют оксиды железа в другие вещества.
- Преобразователи оксидов железа в соли.
- Масла и смолы, обволакивающие частички ржавчины и нейтрализующие ее.

При выборе грунта и краски лучше брать их от одного производителя. Так вы избежите проблем совместимости лакокрасочных материалов.
Защитные краски по металлу
По температурному режиму эксплуатации краски делятся на две большие группы:
- обычные, используемые при температурах до 80 °С;
- термостойкие.
По типу связующей основы краски бывают:
- алкидные;
- акриловые;
- эпоксидные.
Лакокрасочные покрытия по металлу имеют следующие достоинства:
- качественная защита поверхности от коррозии;
- легкость нанесения;
- быстрота высыхания;
- много разных цветов;
- долгий срок службы.
Большой популярностью пользуются молотковые эмали, не только защищающие метал, но и создающие эстетичный внешний вид. Для обработки металла распространена также краска-серебрянка. В ее состав добавлена алюминиевая пудра. Защита металла происходит за счет образования тонкой пленки окиси алюминия.

Эпоксидные смеси из двух компонентов отличаются исключительной прочностью покрытия и применяются для узлов, подверженных высоким нагрузкам.
Защита металла в бытовых условиях
Чтобы надежно защитить металлические изделия от коррозии, следует выполнить следующую последовательность действий:
- очистить поверхность от ржавчины и старой краски с помощью проволочной щетки или абразивной бумаги;
- обезжирить поверхность;
- сразу же нанести слой грунта;
- после высыхания грунта нанести два слоя основной краски.
При работе следует использовать средства индивидуальной защиты:
- перчатки;
- респиратор;
- очки или прозрачный щиток.
Способы защиты металлов от коррозии постоянно совершенствуются учеными и инженерами.
Методы противостояния коррозионным процессам
Основные методы, применяемые для противодействия коррозии, приведены ниже:
- повышение способности материалов противостоять окислению за счет изменения его химического состава;
- изоляция защищаемой поверхности от контакта с активными средами;
- снижение активности окружающей изделие среды;
- электрохимические.
Первые две группы способов применяются во время изготовления конструкции, а вторые – во время эксплуатации.
Методы повышения сопротивляемости
В состав сплава добавляют элементы, повышающие его коррозионную устойчивость. Такие стали называют нержавеющими. Они не требуют дополнительных покрытий и отличаются эстетичным внешним видом. В качестве добавок применяют никель, хром, медь, марганец, кобальт в определенных пропорциях.

Нержавеющая сталь AISI 304
Стойкость материалов к ржавлению повышают также, удаляя их состава ускоряющие коррозию компоненты, как, например, кислород и серу — из стальных сплавов, а железо – из магниевых и алюминиевых.
Снижение агрессивности внешней среды и электрохимическая защита
С целью подавления процессов окисления во внешнюю среду добавляют особые составы — ингибиторы. Они замедляют химические реакции в десятки и сотни раз.
Электрохимические способы сводятся к изменению электрохимического потенциала материала путем пропускания электрического тока. В результате коррозионные процессы сильно замедляются или даже вовсе прекращаются.
Пленочная защита
Защитная пленка препятствует доступу молекул активных веществ к молекулам металла и таким образом предотвращают коррозионные явления.
Пленки образуются из лакокрасочных материалов, пластмассы и смолы. Лакокрасочные покрытия недороги и удобны в нанесении. Ими покрывают изделие в несколько слоев. Под краску наносят слой грунта, улучшающего сцепление с поверхностью и позволяющего экономить более дорогую краску. Служат такие покрытия от 5 до 10 лет. В качестве грунта иногда применяют смесь фосфатов марганца и железа.
Защитные покрытия создают также из тонких слоев других металлов: цинка, хрома, никеля. Их наносят гальваническим способом.
Покрытие металлом с более высоким электрохимическим потенциалом, чем у основного материала, называется анодным. Оно продолжает защищать основной материал, отвлекая активные окислители на себя, даже в случае частичного разрушения. Покрытия с более низким потенциалом называют катодными. В случае нарушения такого покрытия оно ускоряет коррозию за счет электрохимических процессов.
Металлическое покрытие также можно наносить также методом распыления в струе плазмы.
Применяется также и совместный прокат нагретых до температуры пластичности листов основного и защищающего металла. Под давлением происходит взаимная диффузия молекул элементов в кристаллические решетки друг друга и образование биметаллического материала. Этот метод называют плакированием.
Коррозия и защита материалов
Металлы вследствие своей высокой прочности, пластичности, износоустойчивости, тепло- и электропроводности являются наиболее важными конструкционными материалами.
В процессе эксплуатации в результате воздействия окружающей среды происходит их разрушение, так называемая коррозия.
Потери от коррозии в ведущих индустриальных странах составляют около 3-5% валового национального продукта, а затраты на возмещениекоррозионных потерь во всем мире исчисляются сотнями миллиардов долларов, поэтому раздел «Коррозия металлов и методы защиты их от коррозии» является одним из важнейших в курсе химии для инженерных специальностей.
Обычно корродируют металлы, которые встречаются в природе не в самородном состоянии, как Au, Pt, а в виде различных руд. На извлечение этих металлов из природных соединений расходуется значительное количество энергии (Ме +n + n? → Me 0 ; ΔG>0), которая накапливается в металлах, делая их термодинамически неустойчивыми, химически активными веществами (Ме 0 — n? → Me + n ; ΔG 0).
Механическое разрушение металлов, происходящее по физическим причинам, не называют коррозией, а называют эрозией, истиранием, износом.
По характеру разрушения поверхности коррозию подразделяют на сплошную и местную. Сплошная коррозия подразделяется на равномерную, если процесс окисления происходит по всей поверхности металла с одинаковой скоростью, и неравномерную – процесс окисления происходит по всей поверхности с различной скоростью на различных участках металла.
Местная коррозия подразделяется на коррозию пятнами, точечную, питтинг (углубленно-точечную), межкристаллитную (наиболее опасна, т.к. ослабляет связи между зернами структуры сплавов), растрескивающуюся, селективную (избирательную).
По механизму протекания различают следующие виды коррозии:
— электрохимическая (концентрационная, контактная, электрокоррозия);
— особые виды (биологическая, радиационная, ультразвуковая).
По характеру дополнительных воздействий различают:
— коррозию под влиянием механических напряжений;
— коррозию при трении;
— кавитационную коррозию (возникает при одновременном коррозионном и ударном воздействии агрессивной среды, когда лопаются пузырьки воздуха при работе лопастей гребного винта, роторов насосов).
Рассмотрим более подробно виды коррозии по механизму протекания.
Под химической коррозией понимают разрушение металлов окислением в окружающей среде без возникновения электрического тока в системе.
Газовая коррозия протекает при обычных условиях, но чаще при высоких температурах. Наблюдается при разливе расплавленных металлов, их термической обработке, ковке, прокатке, сварке и т.д.
Самый распространенный случай газовой коррозии – взаимодействие металла с кислородом:
Образующаяся при такой коррозии оксидная пленка в ряде случаев играет защитную функцию. Для этого она должна быть сплошной, беспористой, иметь хорошее сцепление с металлом, обладать твердостью, износостойкостью и иметь коэффициент термического расширения, близкий к этой величине для металла. Все эти качества оксидной пленки можно оценить по фактору Пиллинга-Бэдвордса (a). Металлы (щелочные, щелочноземельные), у которых a2O3, ZnO, NiO и т.д.).
При значениях a значительно больше единицы пленки получаются неслошные, лекго отделяющиеся от поверхности металла (железная окалина). Коррозионно-активными газами, кроме кислорода, являются: угарный газ, углекислый газ, сернистый ангидрид, азот, его оксиды и галогены. Например, при разливе расплавленного алюминия, происходит его взаимодействие не только с кислородом, но и с азотом воздуха.
Жидкостная коррозия протекает, как правило, в жидких неэлектролитах: спиртах, хлороформе, бензоле, бензине, керосине и других нефтепродуктах. Ускоряет процесс жидкостной коррозии сера,кислород, галогены, влага, атакже повышенная температура (коррозия поршней в двигателях внутреннего сгорания),что можно описать уравнениями : Me(II) + R1 – S – R2 → MeS + R1 – R2
Me(I) + nR – Cl → MeCl + 1/2nR – R ,
где R1 – S – R2и nR – Cl углеводороды, содержащие серу и хлор.
Электрохимическая коррозия наиболее распространенный вид коррозии. Это разрушение деталей, машин, конструкций в грунтовых, речных, морских водах, под влиянием воды (росы), под воздействием смазочно-охлаждающих жидкостей, используемых при механической обработке металлов, атмосферная коррозия и т.д.
Электрохимическая коррозия – это пространственно разделенный окислительно-восстановительный процесс разрушения металла, протекающий в среде электролита, с возникновением внутри системы электрического тока, называемого коррозионным током.
Рассмотрим химизм атмосферной коррозии стального изделия. Сталь – это сплав железа с углеродом, в котором углерода менее 2%, например, цементит (Fe3C4). При электрохимической коррозии во влажном воздухе (О2 + 2Н2О) железо и цементит образуют микрогальванопару, в которой роль анода выполняет железо, а цементит – роль катода.
Схема процесса:
Анодный процесс: Fe 0 — 2? → Fe 2+ 2 поляризация
Катодный процесс: 2H2O + O2 + 4? → 4OH — 1 деполяризация
Суммарное уравнение коррозионного процесса разрушения стального изделия, находящегося во влажном воздухе:
Для железа более характерна степень окисления (3+), поэтому процесс окисления идет дальше:
4Fe(OH)2+2H2O+O2→4Fe(OH)3, образующийся Fe(OH)3 при нагревании может терять воду.
Fe (OH)3 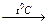 H2O + FeOOH.
H2O + FeOOH.
То есть продуктами коррозии железа (ржавчина) является смесь различных соединений. Если учесть, что в воздухе присутствуют углекислый газ, сернистый газ, следовательно, могут образовываться и соли железа.

Часто из-за различной рельефности металлических конструкций, в том числе и стальных, на некоторых участках скапливается вода, при этом происходит так называемая концентрационная коррозия, обусловленная различной концентрацией деполяризатора кислорода (в случае атмосферной коррозии), водорода (в кислой среде) на различных участках металла. Там, где концентрация деполяризатора больше (края капли воды), формируется катодный участок, где концентрация деполяризатора меньше (центр капли воды) – анодный участок (рис.15).
После высыхания капли в её центре обнаруживается углубление, а иногда даже и отверстие (для пластин толщиной 0,1-0,2 мм). Такие процессы часто наблюдаются при атмосферной и почвенной коррозии железных и стальных изделий (троса, стопки листов и т.д.) – точечная коррозия, переходящая в питтинг. Следует отметить, что хотя конечный продукт коррозии (ржавчина) нерастворим, однако он не препятствует процессу растворения металла, поскольку формируется за пределами анодного участка (на границе соприкосновения его с катодами) в виде кольца внутри капли.
На практике часто встречаются случаи, когда металлы различной активности находятся в контакте друг с другом, образуя гальванопары. Кроме того, технические металлы содержат примеси других металлов, сплавы содержат различные металлы. Такой металл или сплав, находясь в среде электролита, дает множество микро — и макрогальванопар, в которых анодом является более активный металл, т.е. металл с меньшим значением электродного потенциала, именно он и подвергается коррозии.
Рассмотрим случай контактной коррозии с водородной деполяризациейцинка и меди, в сернокислой среде. Цинк и медь, имеют различные значения электродных потенциалов. Более активным в этой гальвано паре является цинк (Е 0 Zn2+/Zn = -0,76 В), он имеет меньшее значение электродного потенциала и будет анодом, т. е именно цинк будет подвергаться коррозионным процессам, менее активным металлом является медь (Е 0 Cu2+/Cu = +0,34 В), она будет катодом.
Запишем схему: (А) Zn | H2SO4 | Cu (K)
Анодный процесс: Zn 0 — 2? → Zn 2+
Катодный процесс: 2Н + + 2? → Н2 деполяризатор
Суммарное ионное уравнение: Zn + 2H + → Zn 2+ + H2
Факторы, влияющие на скорость коррозии:
а) напряжение и деформация при механической обработке металлов;
б) перемешивание агрессивной среды;
в) дифференциальная аэрация;
д) кислотность среды (рН).
Рассматривая фактор (д) обратите внимание, что электродные потенциалы металлов существенно зависят от состава электролита и рН среды. Так, в случае контактной (Al-Zn) коррозии в 1М растворе HCl
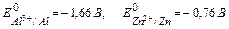 ,
,
возникает гальвано пара, в которой роль анода выполняет Al, а катода- Zn, схема такого процесса: (А) Al | HCl | Zn (K)
В 0,1 М растворе HCl 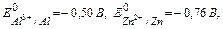 в этом случае большую активность имеет цинк, он будет в гальвано паре анодом, алюминий – катодом, а схему запишем так: (А) Zn | HCl | Al (K)
в этом случае большую активность имеет цинк, он будет в гальвано паре анодом, алюминий – катодом, а схему запишем так: (А) Zn | HCl | Al (K)
Электрокоррозия – протекает под действием блуждающих токов, возникает от постоянных источников тока (электротранспорт, трансформаторы, линии электропередач). Рассматривая коррозию под действием блуждающих токов, надо помнить, что место выхода тока – будет анодным участком, входа тока – катодным, участок протекания тока – нейтральной зоной. Радиус действия блуждающих токов может достигать нескольких десятков километров. Ток силой 1А за год разрушает до 3 кг алюминия, 9 кг железа, 11 кг цинка или меди, 34 кг свинца.
ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
Потери от коррозии в мировой экономике огромны. Около 1/3 вводимого в эксплуатацию металла подвергается коррозии, при этом примерно 10% теряется безвозвратно.
Борьба с коррозией осуществляется различными методами. Наиболее рациональный и надежный путь – изготовление аппаратов и машин изкоррозионно-стойких металлических или неметаллических материалов,но из-за дороговизны таких материалов, чаще используют дешевые и доступные металлы с последующей защитой их от коррозии. Полностью избежать коррозии невозможно, но, применив определенные методы защиты, можно снизить ее воздействие.
Можно условно выделить следующие группы методов защиты металлов от коррозии:
1. Создание рациональных конструкций, т.е. таких, которые не имеют застойных зон и других мест скопления влаги, грязи и других коррозионно-агрессивных сред, допускают быструю очистку и аэрацию.
2. Легирование металлов. Это эффективный, хотя обычно дорогой метод повышения коррозионной стойкости металлов. При легировании в состав сплава вводят компоненты (Cr, Ni, W, Si, V, Mo, Re и другие), вызывающие пассивирование металла. Механизм защиты (например, в нержавеющих сталях) состоит в образовании на поверхности плотных оксидных слоев, типа шпинелей состава NiO . Cr2O, FeO . Cr2O3, которые оказываются более устойчивыми, чем просто оксиды хрома или никеля.
3. Создание аморфных структур металлов. Путь к этому способу защиты открыла сверхбыстрая закалка. Расплавленный металл из тигля подают в тончайший зазор между двумя массивными валками и подвергают формированию и резкому охлаждению. В этих условиях атомы не успевают выстраиваться в присущие металлам кристаллические решетки, фиксируется «хаос атомов», свойственный расплавленному металлу. В результате получается аморфная структура, подобная стеклу, резко возрастает коррозионная устойчивость металлов.
4. Защитные покрытия – самый распространенный метод защиты металлов от коррозии. Смысл их нанесения – изоляция от агрессивной среды. Различают неметаллические и металлические покрытия.
а) неметаллические покрытия получают нанесением на поверхность металла лака, краски, смолы, олифы, эмали или стеклоэмали. Поверхность металла покрывают также резиной, эбонитом, полимерными материалами, цементом, бетоном, оксидными пленками: ZnO, Al2O3 (оксидирование) и нитридными пленками: Fe4N, Fe2N (азотирование). Покрыть поверхность металла можно осаждением нерастворимых фосфатов этого металла: Fe(H2PO4)2 + 2 Fe 2+ ® Fe3(PO4)2¯ + 4H ( фосфатирование) или насыщением поверхности металла углеродом (цементация).
б) защитные покрытия металлами. Для этого используют коррозионно-устойчивые металлы (Sn, Zn, Al, Au, Ag, Ni, Cr и др.) Различают анодные и катодные металлические покрытия. Если защищаемый металл покрывают более активным металлом, то такое покрытие называют анодным. При нарушении покрытия разрушается металл покрытия. Рассмотрим это на примере оцинкованного железа. Составим схему коррозионного разрушения.
A: Zn 0 — 2? → Zn 2+ 2
Если защищаемый металл покрыт менее активным металлом, например, железо покрыто оловом, то такой вид покрытия называется катодным. При нарушении покрытия разрушается основной металл. Рассмотрим этот случай коррозии.
(А) Fe | 2H + | Sn (K)
A: Fe 0 — 2? → Fe 2+ 1
Fe + 2H + → Fe 2+ + H2
5. Электрохимические методы защиты:
а) защита внешним потенциалом);
б) анодная (протекторная).
Защита внешним потенциалом (чаще катодная) осуществляется подключением защищаемой конструкции к отрицательному полюсу (катоду) внешнего источника тока с очень малым напряжением (0,1 В). К положительному полюсу подсоединяется лом, который и разрушается. Этот вид защиты используют для металлических сооружений: трубопроводов, резервуаров и т.д.
Протекторная защита заключается в том, что к изделию, подвергающемуся электрохимической коррозии, подключают деталь – протектор из более активного металла, чем металл изделия. Протектор будет разрушаться, а изделие останется неизменным. Применяют в паровых котлах, для защиты корпусов морских и речных судов, трубопроводов, рельсов и т.д.
Задача. Приведите пример протекторной защиты в электролите, содержащем растворенный кислород. Составьте уравнения анодного и катодного процессов и вычислите ЭДС реакции.
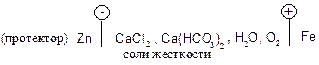
Решение. Протекторная защита осуществляется путем присоединения к железу более активного металла, обычно цинка, магния и их сплавов. Таким образом, создается искусственный микрогальванический элемент. Чаще всего используют протекторную защиту в растворах электролитов (паровые котлы, химические аппараты), в морской воде и в почве (защита трубопроводов). Рассмотрим протекторную защиту от почвенной коррозии:
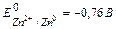
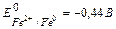
Среда нейтральная или слабощелочная, так как концентрация солей невелика. В этом, созданном нами, коррозионном элементе анодом служит протектор (цинк), он растворяется.
Анод: Zn 0 – 2  ® Zn 2+ .
® Zn 2+ .
Электроны передаются на железо. Деполяризатором в этом случае является кислород.
Катод: O2 + 2H2O + 4 ® 4OH — ; E 0 = 0,40 B.
® 4OH — ; E 0 = 0,40 B.
ЭДС реакции определяем: DЕ = Екатода – Еанода = 0,40 – (-0,75) = 1,16 В.
Ответ: протектор Zn, он окисляется и защищает железо; DЕ = 1,16 В.
6. Воздействие на агрессивную среду. Для замедления коррозии в агрессивную среду вводят вещества, называемые ингибиторами (замедлителями). Это чаще всего органические вещества, пассивирующие поверхность металла: тиомочевина C(NH2)2S, диэтиламин C2H5 — NH — C2H5, уротропин (CH2)6N4, неорганические вещества SiO3 2- , NO2 — , Cr2O7 2- , а также освобождение воды от растворенного в ней кислорода (воду фильтруют через слой железных опилок). Либо удаляют активаторы коррозии, например, ионы Cl — , Br — , F — , SO4 2- , NO3 — .
Литература:
1. Фролов В.В. Химия. Гл.V, §51-56.
2. Лучинский Г.П. Курс химии. Гл.V, §8-12, гл. VI, §13-18
3. Общая химия под ред. Соколовской Е.М. и др. Гл.6, §1-11.
4. Абраменко В.Л. Методические указания к самостоятельному изучению темы “Коррозия и защита металлов от нее”. Луганск, 1991 г.
Коррозии металлов: виды и способы защиты
Термин «коррозия металла» – понятие достаточно широкое, включающее в себя несколько видов постепенного разрушения металлов и их сплавов под действием факторов внешней среды. Чисто механическое воздействие – трение, удары, выветривание – не считается коррозией, а именуется эрозией или истиранием. Фактически, коррозия – это разрушение под действием химического, физико-химического или электрохимического воздействия. При этом физико-химическим воздействием считается ускорение процесса окисления металла под действием повышенной температуры.
Довольно часто этот термин заменяют словом «ржавление», а корродировавший слой – ржавчиной. Но это справедливо только для железа и его сплавов.

Виды коррозии металлов
Учитывая сложность процесса и его многообразие, классификация видов коррозии ведется по нескольким группам признаков:
- механизм – химический или электрохимический;
- окружающая среда. Выделяют общую газовую, атмосферную (с наиболее активным действием кислорода), электролитную и неэлектролитную, подземную (иначе почвенную), биологическую среды. Также агрессивной средой считаются блуждающие токи;
- условия протекания. С погружением, без погружения и частичным погружением в среду, с непосредственным контактом, через щель, в результате трения. Выделяют межкристаллитное воздействие (по границам кристаллов и зон), коррозию под постоянным или переменным электрическим напряжением;
- степень разрушения объекта. Коррозия может быть сплошной, захватывающей всю поверхность объекта (равномерной, неравномерной, избирательной) или локальной. В этом случае отмечают пятна, язвы, точки и сквозные поражения, а также межкристаллитный вариант.
Несколько примеров для лучшего понимания сути и разновидностей коррозии.
- Повреждение днища автомобиля. Считается химическим, с активным действием влаги и атмосферного кислорода, активных газов выхлопа, дорожной «химии» и частично моющих средств при помывке авто. В случае пробоя электропроводки на днище могут воздействовать слабые токи, в этом случае коррозия будет уже электрохимической и заметно ускорится.

- Ржавлениегвоздей и другого крепежа из сплавов железа в строительных конструкциях. Химический процесс, связан с атмосферной влагой и кислородом. При повышенной кислотности материала, в котором установлен крепеж, или увеличении кислотности атмосферных осадков и газовой среды ржавление усиливается и проходит быстрее.

- Сваи в морской воде. Активное воздействие агрессивного электролита (которым является морская вода) приводит к быстрому разрушению металлических конструкций. Скорость коррозии усиливают перепады температуры и механическое воздействие волн.

- Поверхностное разрушение сантехнических устройств и радиаторов отопления. Это характерный пример электрохимической коррозии, где в роли электролита выступает водопроводная вода (теплоноситель в отопительной системе) и моющие средства для сантехники.

Последний вариант (на фото) – это именно коррозия, но не ржавление, поскольку сплав, как правило, создается не на основе железа.
Что происходит с металлом в процессе коррозии
Поверхность металлических объектов в химически или электрически активной среде постепенно разрушается, окисляясь и теряя частицы металла. Их замещение на более хрупкие окислы приводит к потере прочности, изменению эксплуатационных характеристик объекта.
Под действием электролитов (конденсат, дождевая вода и снег, морская и речная, озерная вода, растворы щелочей и кислот, жидкости с высоким содержанием солей) на поверхности металла образуются так называемые гальванические элементы. В зависимости от химического потенциала соприкасающихся материалов металл быстрее или медленнее растворяется. Особенно сильно воздействие коррозии на границе двух металлов – например, в местах установки заклепок на металлический лист или по сварочным швам.

При химической коррозии электрических процессов нет, идет прямое окисление металла атмосферным (или находящимся в газовой, жидкой среде) кислородом. Так, например, образуется окалина при нагреве железистых сплавов до высоких температур (например, во время ковки).

На фото слева – часть кованого ножа, еще не очищенного от окалины, справа – уже отшлифованная.
Отдельно стоит рассмотреть процесс так называемой питтинговой коррозии (язвенной). Этот термин связан с англоязычным понятием pitting, от pit — покрывать(ся) ямками, язвами. В процессе такого разрушения на поверхности металла образуются вначале мелкие, точечные ямки и полости, которые затем разрастаются в глубь массива.

Первичные нарушения целостности наблюдаются в тех местах, где на поверхности металлической детали есть микроповреждения – выход на поверхность зерен, микротрещин, пор, различных включений. Очень часто причиной начала язвенной коррозии являются остатки прокатной окалины, не полностью удаленной при механической обработке и/или нанесении защитного слоя.

Прямые и косвенные проблемы, связанные с коррозией металла
Основная беда коррозии – постепенное разрушение корродировавших частей конструкций и изделий. При этом степень повреждение по внешнему виду можно оценить не всегда, и потеря прочности становится неожиданной и критичной.
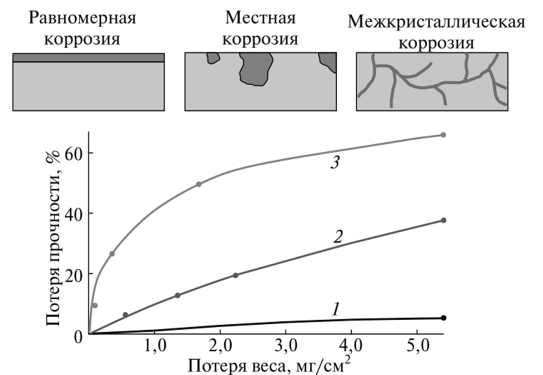
Особенно сильно действует межкристаллическая, то есть проходящая по границам кристаллов, коррозия. Внешне процесс может быть совершенно незаметен, в то время как уровень потери прочности достигает уже 50…60%.
Наименьшее воздействие на прочностные свойства изделий оказывает поверхностное разрушение.

На фото показана часть конструкций башни Шухова в Москве. Поверхностное ржавление существенно снизило конструктивную прочность, но не привело к разрушению сооружения (пока)
Оценить уровень потерь от коррозии металла крайне сложно. Дело даже не в непосредственных убытках от разрушения корродировавших деталей или конструкций, а в простоях техники и сооружений и нарушениях их работоспособности в целом, связанных с коррозионным разрушением отдельных элементов.
Способы защиты металлов от коррозии
Предотвращение начала или активного протекания коррозии – более удачный способ избавиться от проблем с разрушением металлов, чем постоянная замена или восстановление деталей. Поэтому все производители металлических изделий уделяют максимум внимания разработке и совершенствованию способов защиты своей продукции от ржавления.
На данный момент есть четыре основных направления:
- изменение свойств металла введением добавок. По этому принципу изготавливаются нержавеющие стали – добавки хрома (12%) повышают стойкость сплава к коррозии до почти полной невосприимчивости в нормальных бытовых условиях. Изменения температуры и состава окружающей среды снижают стойкость нержавеющей стали к коррозии;
- использование защитных покрытий. Применяются различные (в чистом виде и комбинациях) лако-красочные, эмалевые, полимерные составы. Также – и с большим успехом – используется поверхностное нанесение менее активных химически металлов (оцинковывание, хромирование, никелирование, золочение);
- применение небольших элементов (пластинок, заклепок) из более активных металлов для сохранения основного объема и массы изделия – коррозии в этом случае подвергаются именно добавленные элементы. Отдельно можно выделить создание слабого тока в самом изделии для нейтрализации тока электрохимической коррозии. Применение этого способа ограничено определенными условиями эксплуатации;
- введение ингибиторов – веществ, угнетающих процесс коррозии – в окружающую изделие среду.
Последний метод требует отдельного рассмотрения.
Применение ингибиторов коррозии
По свойствам эти сложные химические составы делятся на две группы – средства, уменьшающие коррозионную активность внешней среды (пассиваторы) и комплексы, образующие на поверхности защищаемого изделия предохраняющий от коррозии слой адсорбирующего типа (адсорбаторы).
Очень часто ингибиторы применяют в магистралях и локальных системах отопления. В этом случае существенно уменьшается внутренняя коррозия трубопроводов и радиаторов отопления под действием теплоносителя.
Также ингибиторы, в сочетании с другими компонентами, используются для профилактики и очистки водопроводов, водонагревающих устройств.
Также широко распространено применение ингибиторов в строительстве, в том числе в создании арматуры железобетонных конструкций. Обработка специальным составом препятствует коррозии арматуры в монолите и продлевает срок службы железобетона. Также сохраняется нагрузочная способность конструкции, поскольку целостность арматуры позволяет сохранять нормальный уровень сопротивления нагрузкам.

Используются ингибиторы как в виде жидкостей, так и в виде газов, вводимых в окружающую изделие среду.
Защита автомобильной техники от коррозии
Обслуживание личного авто или другой техники – это именно та область, где люди чаще всего сталкиваются с коррозионными явлениями и необходимостью защиты от них.
Поэтому отдельно рассмотрим средства для защиты автомобилей, других транспортных средств и механизмов от коррозии и связанных с ней поломок.
Гидроизолирующие мастики. Чаще всего встречаются битумно-каучуковые, резино-битумные, сланцевые. По сути дела, это жидкая гидроизоляция, которая в горячем или холодном виде наносится на металлические (и не только) элементы механизмов. Получается достаточно стойкая защита от действия атмосферной влаги, как в прямом виде (дождь, снег), так и конденсата, а также от воды в процессе мытья техники. Использование возможно только на внутренних элементах механизмов (под капотом автомобиля или на его днище, например). Впрочем, при низких требованиях к эстетике возможна и наружная обработка – все зависит от назначения элемента и особенностей его работы.

Обмазочные материалы на основе парафина, воска или нефтяного масла. Создают на поверхности металлических деталей тонкую эластичную пленку, предохраняющую от коррозии. Требуют периодического возобновления покрытия, особенно на поверхностях, активно подвергающихся внешнему воздействию. Среди перечня этих средств стоит выделить так называемое «Пушечное сало».

Жидкие маловязкие материалы для скрытых полостей. Используются для обработки труднодоступных элементов техники, куда можно проникнуть только через технологические отверстия малого диаметра – соответственно, обмазочная изоляция невозможна. Маловязкие жидкости, имеющие очень высокую текучесть, обволакивают детали и вытесняют с их поверхности влагу, образуют полувысыхающую стойкую пленку.

Аэрозольные составы. Принцип их действия тот же, что и у обмазочной гидроизоляции, различие лишь в способе нанесения. Почти всегда составы содержат ингибиторы коррозии.
Таким образом, обработка днища автомобиля от коррозии – места, больше всего подверженного ржавлению – и других элементов машины возможна любым из перечисленных типов средств, в зависимости от условий эксплуатации и назначения/расположения защищаемой детали.
Заключение
Напоследок хочется еще раз напомнить: гораздо дешевле и проще (в том числе по временным затратам) выходит предварительная защита конструкций и механизмов от коррозии различного типа, чем последующий ремонт и замена поврежденных деталей.













