|
| Книга | Описание | Год | Цена | Тип книги |
|---|---|---|---|---|
| Коррозия и защита от коррозии | Настоящая книга является первым полномасштабным учебным изданием по коррозии для химико-технологических и машиностроительных специальностей высших учебных заведений (1-е издание — 2002 г., 2-е… — ФИЗМАТЛИТ, (формат: 60×90/16, 416 стр.) Подробнее. | 2010 | 764 | бумажная книга |
См. также в других словарях:
Коррозия арматуры, характер коррозии — – вид коррозионных поражений: налет, равномерная, точечная, пятнами, слоистая, язвами. [Терминологический словарь по бетону и железобетону. ФГУП «НИЦ «Строительство» НИИЖБ им. А. А. Гвоздева, Москва, 2007 г. 110 стр.] Рубрика термина: Виды … Энциклопедия терминов, определений и пояснений строительных материалов
ЗАЩИТА ОТ КОРРОЗИИ — конструкционных материалов в агрессивных средах основана на: 1) повышении коррозионной стойкости самого материала; 2) снижении агрессивности среды; 3) предотвращении контакта материала со средой с помощью изолирующего покрытия; 4) регулировании… … Химическая энциклопедия
Защита от коррозии — (антикоррозионная защита) – способы и средства, предотвращающие или уменьшающие коррозию бетонных или железобетонных конструкций, арматуры. [Терминологический словарь по бетону и железобетону. ФГУП «НИЦ «Строительство» НИИЖБ им. А. А.… … Энциклопедия терминов, определений и пояснений строительных материалов
Защита от коррозии вторичная — – защита от коррозии, достигаемая ограничением или исключением воздействия агрессивной среды путем окраски, пропитки, изоляции и другими мерами, после изготовления конструкции. [Терминологический словарь по бетону и железобетону. ФГУП «НИЦ… … Энциклопедия терминов, определений и пояснений строительных материалов
Защита от коррозии первичная — – электрохимическая защита стальной арматуры, осуществляемая от внешнего источника тока или путем соединения с металлом, имеющим более отрицательный потенциал, чем у стальной арматуры в бетоне. [Терминологический словарь по бетону и… … Энциклопедия терминов, определений и пояснений строительных материалов
Защита от коррозии специальная — – способы и средства, предотвращающие или уменьшающие коррозию бетонных или железобетонных конструкций. [Терминологический словарь по бетону и железобетону. ФГУП «НИЦ «Строительство» НИИЖБ им. А. А. Гвоздева, Москва, 2007 г. 110 стр.]… … Энциклопедия терминов, определений и пояснений строительных материалов
Защита от коррозии строительного материала — – способы и средства, уменьшающие или предотвращающие коррозию строительного материала. [СТ СЭВ 4419 83] Рубрика термина: Защита от коррозии Рубрики энциклопедии: Абразивное оборудование, Абразивы, Автодороги … Энциклопедия терминов, определений и пояснений строительных материалов
СТ СЭВ 4419-83: Защита от коррозии в строительстве. Конструкции строительные. Термины и определения — Терминология СТ СЭВ 4419 83: Защита от коррозии в строительстве. Конструкции строительные. Термины и определения: 2. Агрессивная среда Среда, воздействие которой вызывает коррозию строительного материала в изделии или конструкции Определения… … Словарь-справочник терминов нормативно-технической документации
СТО Газпром 9.0-001-2009: Защита от коррозии. Основные положения — Терминология СТО Газпром 9.0 001 2009: Защита от коррозии. Основные положения: 3.1 атмосферная коррозия : Коррозия, в которой коррозионной средой является земная атмосфера в ее собственном интервале температур. Определения термина из разных… … Словарь-справочник терминов нормативно-технической документации
СТО 17330282.27.060.001-2008: Трубопроводы тепловых сетей. Защита от коррозии. Условия создания. Нормы и требования — Терминология СТО 17330282.27.060.001 2008: Трубопроводы тепловых сетей. Защита от коррозии. Условия создания. Нормы и требования: 3.1 адгезия: Совокупность сил связи между высохшей пленкой и окрашиваемой поверхностью. Определения термина из… … Словарь-справочник терминов нормативно-технической документации
СТО 70238424.27.060.002-2008: Трубопроводы тепловых сетей. Защита от коррозии. Организация эксплуатации и технического обслуживания. Нормы и требования — Терминология СТО 70238424.27.060.002 2008: Трубопроводы тепловых сетей. Защита от коррозии. Организация эксплуатации и технического обслуживания. Нормы и требования: 3.1 адгезия : Совокупность сил связи между высохшей пленкой и окрашиваемой… … Словарь-справочник терминов нормативно-технической документации
ЗАЗ Sens Лунная Дорога › Бортжурнал › Устройство катодной защиты кузова автомобиля от коррозии

Нашел я статью в сети, про катодную защиту она меня очень заинтриговала …чуть ниже привожу ее …
. Автомобиль, проехавший по дороге, посыпанной реагентом, становится жертвой коррозии. И чем больше автомобиль будет забрызган грязью с дорожного полотна, тем активнее будет коррозия кузова. Реагент, находящийся на поверхности кузова, даже в сухом гараже притягивает к себе молекулы воды из воздуха, как любая соль. И чем выше влажность воздуха, тем активнее пагубное воздействие реагента.Соль делает своё коварное дело в любых условиях, разница лишь в скорости коррозии металла. Хорошо, если металл окрашен, а если имеется хотя бы небольшая царапина, то ржавчина сразу туда проникает. И не везде помогут антикоррозийные покрытия, или мастики. Ведь мелкую царапину изначально трудно заметить, а когда она превратится в сквозную коррозию, будет уже поздно. Да и необходимо постоянно следить за кузовом, чтобы своевременно закрасить краской, или замазать антикорозийкой появившийся скол краски от удара камня.
Думаю Вы замечали, отечественные автомобили ржавеют очень быстро, европейские немного медленнее, а японские автомобили – наиболее стойкие к коррозии. Для уменьшения коррозии, ещё на этапе производства автомобиля применяют различные способы защиты кузова. Например, японцы, живущие на островах, в условиях влажного морского климата применяют специальную обработку кузова автомобиля высокими частотами. Один из способов защиты от коррозии – оцинковка поверхности металла. Замечено, что после ремонта автомобиля, сварные швы наиболее подвержены коррозии. Ускорение коррозии происходит из-за высокотемпературного «ослабления» металла.
Наиболее простым и действенным способом защиты кузова автомобиля от коррозии является – катодная защита. Это вид активной – электрохимической защиты.
Изучая эту тему в Интернете, я столкнулся с тем, что она описывается не совсем «специалистами». Статьи либо пишутся автолюбителями, мало соображающими в электронике, либо электронщиками, мало понимающими в электрохимических процессах и плохо представляющими принцип катодной защиты на автомобилях. Поэтому, в основном у них получается экспериментальный, не оптимальный и малоэффективный вариант устройств защиты. В этой статье, мы рассмотрим принцип и способы реализации катодной защиты от коррозии и разработаем оптимальный её вариант.
Принцип действия катодной защиты состоит в следующем:
В качестве катода (минуса) используется корпус автомобиля, а в качестве анода (плюса) – металлические сооружения, различные пластины и другие окружающие поверхности, проводящие ток, в том числе и влажное дорожное покрытие. Из-за разности потенциалов между защищаемой поверхностью металла и поверхностью «анода» по цепи, образующейся через влажный воздух, проходит слабый ток. На аноде происходит реакция окисления — освобождение электронов. Анод, постепенно окисляясь, разрушается, а разрушение катода наоборот прекращается.
В некоторых статьях Интернета по теме катодной защиты приводится разность потенциалов между катодом и анодом: Для железа и его сплавов полная защита от коррозии достигается при потенциале 0,1…0,2 В. Дальнейший сдвиг потенциала в сторону увеличения мало влияет на степень защиты. Плотность защитного тока должна быть в пределах 10…30 мА/м2.
На самом деле эти цифры кем-то «надуманы» для тех, кто не знает, что такое электрический ток. Но мы то с Вами знаем. Анод и катод можно расположить на расстоянии одного сантиметра друг от друга, а можно и на расстоянии нескольких сантиметров и даже метров. По законам электрохимии, для эффективности, чем дальше электроды находятся друг от друга, тем больше должна быть разница потенциалов. Поэтому говорить о конкретном значении в 0,1…0,2 вольта – неправильно. Кроме того, воздух, который используется в качестве электролита, проводит электрический ток только с большой разницей потенциалов – порядка киловольт, а маленькое напряжение ему «как слону дробина». Поэтому, по закону Ома, о наличии защитного тока, как и о его плотности в пределах 10…30 мА/м2 говорить также нелепо. Этого тока просто не будет!
Другое дело, если мы будем рассуждать не об электрическом токе, а о разности зарядов (или потенциалов). Тогда можно будет говорить о концентрационной поляризации по кислороду, при котором молекулы воды, попадая на поверхность металла, ориентируются на поверхностях электродов так, что на аноде происходит освобождение электронов — реакция окисления, а на катоде наоборот, окисление прекращается. Так как электрический ток отсутствует, то освобождение электронов происходит очень медленно. Этот процесс безопасен и не заметен для глаз. Учитывая эффект поляризации молекул воды, наблюдается дополнительное смещение потенциала кузова автомобиля в отрицательную сторону, что позволяет периодически выключать устройство защиты от коррозии (при ремонте автомобиля, зарядке аккумулятора и т.п.). Особо необходимо отметить важный момент, чем больше площадь анода (анодов), тем эффективнее защита.
В качестве защищаемого катода, как было описано ранее, используется корпус автомобиля. Нам необходимо выбрать, что мы будем использовать в качестве анода.
Ещё раз повторюсь, для работы схемы защиты нам не требуется ток, протекающий между электродами. Если он будет, то это будет «побочный» ток, который может возникнуть в результате намокания анодов, колёс автомобиля и т.д. Это ток разряжающий аккумулятор и не более того. Поэтому автомобильную бортовую сеть + 12 вольт достаточно подключить к аноду (нескольким анодам) через добавочный резистор. Основное назначение резистора – ограничение тока разряда аккумуляторной батареи в случае замыкания анода на катод, которое может произойти по причинам «неудачной установки», повреждения анода, его химического разложения в результате окисления и т.д.
Варианты анодов, применяемых на автомобиле, находящемся на стоянке (гараже): металлическое сооружение, находящееся в непосредственной близости от автомобиля, например металлический гараж, в котором хранится автомобиль; контур заземления, используемый при отсутствии металлического гаража, в том числе на открытой стоянке. Другие варианты анодов, применяемых на движущемся, или находящемся на стоянке (гараже) автомобиле: металлизированный резиновый заземляющий «хвост»; защитные электроды (протекторы) на кузове автомобиля.
Рассмотрим все перечисленные варианты
1. Использование металлического гаража в качестве анода является наиболее простым способом защиты главным образом внешних металлических поверхностей облицовки автомобиля. Если пол в гараже также железный, или содержит открытые участки металлической арматуры, то тогда защищается и поверхность днища автомобиля. Летом, как правило, в металлическом гараже – парниковый эффект, который при катодной защите не разрушает, а наоборот сохраняет и очищает кузов автомобиля от коррозии. Для создания такой защиты достаточно корпус гаража подключить к плюсу аккумуляторной батареи, установленной в автомобиле через обыкновенный добавочный резистор и монтажный провод. В качестве плюса, можно использовать прикуриватель, при условии, что в нём есть напряжение в режиме стоянки при отключенном замке зажигания (не у всех автомобилей при отключенном зажигании работает прикуриватель).
2. Использование контура заземления в качестве анода подобно использованию металлического гаража. Разница состоит лишь в том, что главным образом от коррозии защищается днище автомобиля. Для создания лучшего контура заземления, по периметру автомобиля необходимо забить в грунт четыре металлических кола (стержня) длиной не менее одного метра. Колы, электрически соединяются друг с другом с помощью проволоки. Контур подключается к автомобилю точно так же, как и корпус гаража – через добавочный резистор.
3. Металлизированный резиновый заземляющий «хвост» — простой и эффективный способ защиты движущегося автомобиля. В условиях влажного воздуха – дождя, мокрого дорожного покрытия, создается разность потенциалов между кузовом автомобиля и дорожным покрытием. Влажный воздух и мокрое дорожное полотно усиливает коррозию кузова автомобиля, но в данном случае наблюдается обратное — чем больше влажность, тем эффективнее антикоррозийная работа заземляющего хвоста. Хвост устанавливается сзади автомобиля так, чтобы в сырую погоду, при движении автомобиля, на хвост летели брызги воды от заднего колеса. Это улучшает эффективность антикоррозийной защиты.
Вторая функция заземляющего хвоста – он выполняет функцию антистатического приспособления. Я думаю, вы замечали, на бензовозах всегда волочится и гремит металлическая цепь, предназначенная для исключения накопления статического заряда на корпусе автомобиля и как следствие – исключения возникновения электрической искры, опасной для перевозимого груза. В некоторых статьях Интернета пишут, что цепь, волочащаяся за бензовозом – это антикоррозийное приспособление. К таким наблюдениям можно отнестись только с улыбкой.
Хвост должен быть изолирован от корпуса автомобиля по постоянному току и наоборот «закорочен» на корпус по переменному току. Достигается это RC-цепочкой, представляющей собой элементарный частотный фильтр.
4. Использование в качестве анодов защитных электродов — протекторов, практически отдельная тема. Элементарные металлические пластинки — «защитные протекторы» прикрепляются в наиболее уязвимых для коррозии местах — под крыльями, на днище кузова, на порогах. Они отвлекают на себя ржавчину за счёт того же эффекта, что и все предыдущие варианты анодов. Достоинство такого способа – постоянное наличие анода, стоит машина или едет. Такая локальная защита, говорят, дает хорошие результаты. Правда, анодов надо установить штук 15-20. Это трудоемко, но думаю «овчинка выделки стоит».
В качестве защитных электродов (анодов) могут использоваться как разрушающиеся материалы (нержавеющая сталь, алюминий), требующие замены через 4…5 лет, так и неразрушающиеся. В качестве неразрушающихся электродов можно применять карбоксил, магнетит, графит или платину. Защитные электроды выполняются в виде прямоугольных либо круглых пластин площадью 4…10 см2.
При установке и монтаже электродов следует помнить, что:
— один защитный электрод защищает площадь с радиусом около 0,25…0,35 м;
— защитные электроды устанавливаются только на места, защищенные лакокрасочным покрытием;
— для крепления электродов рекомендуется использовать только эпоксидный клей или шпатлевку на его основе, предварительно зачистив глянец (эпоксидный клей на глянец не прилипает), но думаю, что это не догма;
— наружную сторону защитных электродов (где нет пайки) нельзя покрывать мастикой, краской, клеем или другим электроизоляционным покрытием.
Пластины-протекторы — это положительные пластины конденсатора, которые должны быть изолированы от отрицательной пластины — кузова автомобиля. Но расстояние между пластинами должно быть небольшим, чтобы ёмкость этого конденсатора была достаточной — на большом расстоянии между пластинами электрическое поле будет стремиться к нулю. Лакокрасочное покрытие автомобиля и эпоксидный клей, находящиеся в промежутке между кузовом и пластинами — это диэлектрическая прокладка конденсатора.
Установка электродов в этих точках наиболее эффективна:
1 — коробчатые усилители брызговиков; 2 — места крепления фар и подфарников; 3 — нижняя часть передней панели; 4 — полости за щитками-усилителями передних крыльев; 5 — внутренние поверхности дверей и порогов; 6, 7 — передняя нижняя часть заднего крыла и арка колеса по стыку с крылом; 8 — фартук задней панели.
Провода к протекторным пластинам подключаются через проколы в резиновых заглушках, закрывающих отверстия в днище автомобиля, которые предусмотрены его конструкцией.
Другой вариант использования меньшего количества электродов, но с большей площадью самих пластин:
Выглядит вполне логично, зачем устанавливать много электродов малой площади, если можно установить мало электродов, но большего размера. Главное, установить их в местах наиболее подверженных коррозии, или вблизи этих мест. Кроме того, в связи с тем, что в качестве «электролита» выступает влажный воздух, пластины должны располагаться обращёнными не внутрь (внутри короба, куда не проникает влага), а наружу – навстречу агрессивной среде, например брызгам от колеса.
Кузов автомобиля током бить не может, так как токи антикоррозийной защиты очень слабые. Даже если вы положите голую пластину под обнажённое «седалище», вы почувствуете только твёрдый металл этой пластины, не более. В антикоррозийной защите используется слабый постоянный ток, который создает слабое электрическое поле, а по альтернативной теории электрического тока — магнитное поле, только в промежутках между кузовом и местом установки протекторов. Поэтому электромагнитное поле обыкновенного сотового телефона более, чем в 100 раз сильнее, поля создаваемого катодной защитой.
Думаю, что элементарных теоретических понятий достаточно, поэтому перейдём к разработке устройства антикоррозийной защиты.
Учитывая особенности и специфику использования различных вариантов анодов, конечно лучшим вариантом является одновременное использование всех перечисленных ранее способов.
Схема устройства простейшая. Самое сложное – изготовление «заземляющего хвоста» и установка «протекторных пластин».
Изучая вопрос протекторной защиты в Интернете, я не встретил ни одной схемы, которая оптимально выполняет задачу защиты от ржавчины. Вернёмся к тому, что в некоторых статьях пишут, что полная защита от коррозии достигается при потенциале 0,1…0,2 В. Дальнейший сдвиг потенциала в сторону увеличения мало влияет на степень защиты. Мы не будем оспаривать этого предлагаемого значения. Защитного тока фактически не существует, он возникает только в случае «появления» проводника, образующегося за счёт проводимости воды, попадающей на пластины протекторов, или на покрышки колёс. Исходя из этого, можно сделать вывод: Если мы будем стремиться к значению 0,1…0,2 вольта, тогда придется ставить делитель напряжения, а это — лишний – паразитный разряд аккумулятора впустую. Если увеличение потенциала, не ухудшает степень защиты, тогда проще подать на аноды все 12 вольт, которые будут сами по себе «падать» в зависимости от влажности пластин. Достигается это обыкновенным добавочным резистором. Необходимо рассчитать его на такой ток, при котором в случае замыкания протекторных пластин на корпус автомобиля, происходит «безопасный» разряд аккумуляторной батареи. Абсолютно все, встречающиеся в Интернете схемы катодной защиты либо имеют фиксировано малую разницу потенциалов между анодом и катодом (до 1,8 вольта), либо имеют большую разницу потенциалов (до 8…11 вольт), но авторы этих схем описывают их, как «выдающие» 0,1…0,2 вольта. Разница этих схем – в максимальном токе, определяемом добавочным резистором. Непонятно, они или сами не умеют рассчитать простейший делитель напряжения, или пытаются обмануть Вас?
Из руководства по эксплуатации автомобиля, автомобилисты знают, что устойчивый пуск двигателя с помощью стартера возможен, если емкость аккумулятора составляет не менее 60% номинальной. Если использовать одно из устройств, публикуемых авторами разных статей с током потребления 5 мА, то время, в течение которого аккумулятор можно не подзаряжать составит 40 дней. С учетом саморазряда аккумулятора это время будет еще меньше. При постоянном использовании автомобиля это не опасно, но если Вы собрались в отпуск, или длительную командировку, то такое устройство следует отключить от аккумулятора автомобиля.
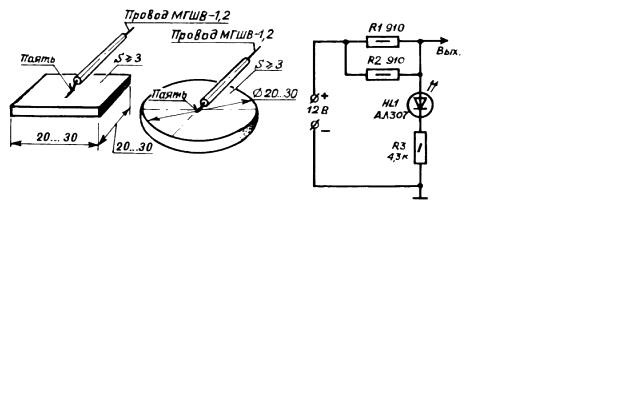
Приведу популярную схему катодной защиты, даже с рисунками протекторов:
На рисунке, вывод «Вых.» подсоединяется на пластины-протекторы. Против таких протекторов я ничего не имею, поскольку их геометрия мало влияет на степень защиты (можете вырезать хоть звездочку), а влияет лишь площадь пластин.
Определим, какое же напряжение подается на пластины, и какой ток потребляет устройство?
На кристалле светодиода HL1 типа АЛ307БМ падение постоянного прямого напряжения равно 2 В (из справочника).
Остальные 10 В падают на резисторах.
Общее сопротивление R1+R2+R3 будет равно 4855 Ом (R1+R2 в параллель и R3 последовательно).
Ток делителя будет равен Iдел = U / Rобщ. = 10/4855 = 2,1 mA.
Отсюда: Напряжение на выходе Uвых = Iдел * R3 + UHL1 = 2,26 * 4300 + 1 = 10,8 B.
Где же заявляемые 0,1…0,2 вольта? Мало того, в этой схеме, проходящий через светодиод ток 2,1 mA его толком и не зажжёт, у светодиода номинальный ток 10 mA.
Кроме того, на лицо «паразитный» ток разряда аккумуляторной батареи – через делитель. Вывод: схема придумана малограмотным экспериментатором.
Подобная схема с «паразитным» разрядом аккумуляторной батареи приводится в схеме с заземляющим хвостом:
Защита металлических изделий от коррозии

Вопросы, рассмотренные в материале:
- Почему важна защита металлических изделий от коррозии
- Какие виды коррозии существуют
- Какие есть способы защиты металлических изделий от коррозии
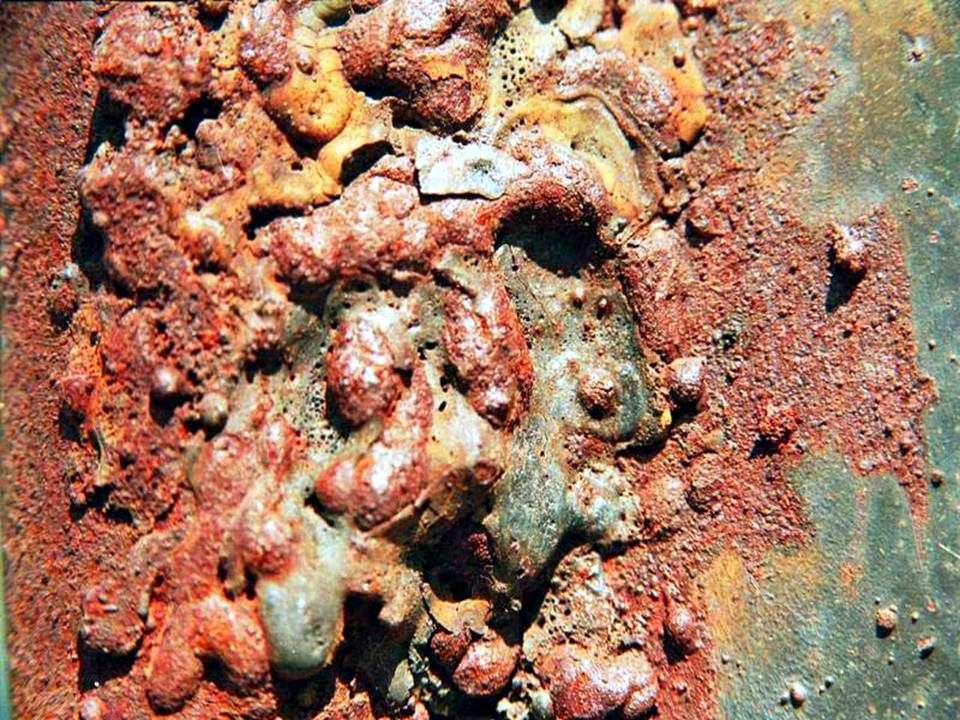
Человек с глубокой древности использует предметы из металлов. До сих пор они остаются важной составляющей нашей жизни, причем самыми востребованными являются изделия из железа и его сплавов. Однако все они имеют один серьезный минус, а именно подверженность коррозии, то есть способность разрушаться в процессе окисления. Своевременная защита металлических изделий от коррозии дает возможность увеличить их срок службы.
Почему так важна защита металлических изделий от коррозии

Коррозия оказывает негативное электрохимическое, химическое воздействие на целостность поверхности предметов из стали, чугуна. В результате происходит разъедание металлических изделий, они портятся и не могут использоваться по назначению.
По статистике экспертов, каждый год примерно 10 % от объема всех добываемых на планете металлов приходится расходовать на устранение потерь, вызванных коррозией. Ведь последняя приводит к полной утрате металлическими предметами своих эксплуатационных свойств.
Как только на изделиях из чугуна или стали появляются признаки коррозии, у них снижается герметичность, прочность. Параллельно падает их способность проводить тепло, пластичность, отражательный потенциал, иными словами, утрачивается целый ряд немаловажных свойств. Все это приводит к тому, что конструкции оказываются непригодны для использования по назначению. Вот почему так важно грамотно и своевременно применять существующие способы защиты металлических изделий от коррозии, о которых далее пойдет речь.
Основные виды коррозии

Прежде чем приступать к защите металлических изделий от коррозии, важно понять природу этого процесса. Принято выделять такие типы коррозии:
- Атмосферная. Причиной окисления становится контакт металлического предмета с кислородом и содержащимися в воздухе водяными парами. Ржавчина образуется быстрее, когда в воздухе присутствуют загрязнения в виде химически активных веществ.
- Жидкостная. Формируется на металлических предметах, находящихся в водной среде. Если речь идет о морской воде, то в ней окисление значительно ускоряется за счет содержащегося в жидкости большого объема солей.
- Почвенная. Данному типу подвержены металлические изделия, конструкции, находящиеся в грунте. Химические реакции запускаются и протекают под действием химических элементов, входящих в состав грунта, грунтовых вод, разного рода утечек.
Коррозия на металлических изделиях может проявляться по-разному:
- формируется сплошной ржавый слой или его отдельные фрагменты;
- появляются небольшие участки ржавчины, проникающей внутрь детали;
- образуются глубокие трещины;
- окисляется один из компонентов сплава;
- происходит глубинное проникновение по всему объему;
- сочетаются сразу несколько симптомов.
Причины возникновения могут иметь природу двух видов:
- Химическую, то есть металл разрушается в результате химических реакций с активными веществами.
- Электрохимическую, связанную с тем, что при контакте с электролитическими растворами возникает электрический ток, под его действием замещаются электроны металлов. Это приводит к тому, что страдает кристаллическая структура, образуется ржавчина.
Способы защиты металлических изделий от коррозии
Можно выделить несколько основных способов защиты металлических изделий от коррозии:
- легирование металлов;
- защитные покрытия (металлические, неметаллические);
- электрохимическая защита;
- изменение свойств коррозионной среды;
- рациональное конструирование изделий.

1. Легирование металлов.
Это один из действительно эффективных способов, позволяющих увеличить стойкость металлов к ржавчине. В процессе легирования в состав сплава или металла вносят легирующие элементы, такие как хром, никель, молибден, пр. Они приводят к пассивации металла, то есть металл или сплав переходит в состояние повышенной коррозионной устойчивости за счет торможения анодного процесса. Пассивное состояние металла достигается благодаря тому, что на его поверхности формируется совершенная по структуре оксидная пленка. Она обеспечивает защиту изделия лишь при условии, что кристаллические решетки металла и образующегося оксида имеют между собой максимальное сходство.
Рекомендовано к прочтению
Легирование активно используется для защиты, например, закладных деталей от коррозии. Такую обработку проводят для железа, алюминия, меди, магния, цинка и сплавов на их основе. Получившиеся сплавы, по сравнению с исходными металлами, отличаются повышенной коррозионной стойкостью, а также жаростойкостью и жаропрочностью.
Жаростойкость – способность металла сохранять свои свойства даже при высоких температурах, когда повышается вероятность газовой коррозии.
Жаропрочность – сохранение конструкционным материалом высокой механической прочности при значительном повышении температуры. Этого свойства обычно достигают легированием металлов и сплавов. Так, сталь легируется хромом, алюминием и кремнием. При высоких температурах они окисляются первыми, в результате чего формируются плотные защитные оксидные пленки, например Al2O3 и Cr2O3.
Кроме того, легирование позволяет снизить скорость электрохимической коррозии, особенно когда она сопровождается выделением водорода. Ярким примером коррозионностойких сплавов являются нержавеющие стали, где роль легирующих компонентов играют хром, никель и ряд прочих металлов.
2. Защитные покрытия.

В этом случае на поверхности металлического изделия искусственно формируются дополнительные слои для защиты. На самом деле, этот подход является наиболее распространенным среди существующих способов борьбы с коррозией. Мало того, что подобные покрытия оберегают предмет от появления ржавчины, они придают поверхностям ценные физико-химические характеристики. Речь идет об износостойкости, электрической проводимости и еще ряде свойств. Такие покрытия могут быть металлическими и неметаллическими. Однако, вне зависимости от состава, к ним предъявляются единые требования: хорошие адгезионные качества, сплошность и способность сохранять свои свойства в агрессивной среде.
Металлические покрытия выделяются на фоне других способов защиты металлических изделий от коррозии тем, что обладают неоднозначным действием. Пока защитный слой сохраняет свою целостность, он изолирует поверхность изделия от воздействия окружающей среды. То есть по своему действию близок к любой механической обработке, например, окраске, оксидной пленке, пр. В целом, металлические покрытия не должны пропускать коррозионные агенты.
Если такое покрытие повреждается либо в нем есть поры, образуется гальванический элемент. Нужно понимать, что характер коррозионного разрушения материала во многом зависит от электрохимических характеристик обоих металлов. Защитные антикоррозионные покрытия бывают катодными или анодными. В число первых входят покрытия, потенциалы которых в данной среде являются более положительными, чем у основного металла. Анодные покрытия обладают наиболее отрицательным потенциалом, чем потенциал материала изделия.
Если повреждается никелевое покрытие, на анодных участках железо окисляется за счет образования микрокоррозионных гальванических элементов. На катодных участках происходит восстановление водорода. Таким образом, катодные покрытия обеспечивают защиту металлических изделий от коррозии только при условии, что в покрытии нет пор и повреждений.
Если в цинковом слое появляется местное повреждение, защита продолжит разрушаться, но поверхность железа не пострадает от коррозии. На анодных участках происходит процесс окисления цинка, а на катодных участках – восстановление водорода.
Электродные потенциалы металлов зависят от компонентов и их доли в растворах, поэтому характер используемого для защиты покрытия может быть изменен за счет изменения состава.

Защита деталей от коррозии горячим методом осуществляется при помощи разных металлов и подходов. Сформировать металлические защитные покрытия позволяют несколько способов: электрохимический (гальванические покрытия); погружение в расплавленный металл (горячее цинкование, лужение); металлизация (нанесение расплавленного металла на защищаемую поверхность струей сжатого воздуха); химический (защита изделия посредством восстановителей, таких как гидразин).
Материалами для металлических защитных покрытий могут быть как чистые металлы (цинк, кадмий, алюминий, никель, медь, хром, серебро и др.), так и их сплавы (бронза, латунь и др.).
Неметаллические защитные покрытия делятся на неорганические и органические. Суть такой обработки состоит преимущественно в изоляции металла от окружающей среды.
Для защиты металлических изделий от коррозии неметаллическими покрытиями используют неорганические эмали, оксиды металлов, соединение хрома, фосфора, пр. В число органических входят лакокрасочные покрытия, смолы, пластмассы, полимерные пленки, резина.
По своему составу неорганические эмали являются силикатами, иначе говоря, это соединения кремния. Нужно понимать, что подобные покрытия хрупкие и растрескиваются из-за тепловых и механических ударов.
Лакокрасочные покрытия встречаются более часто. Главные условия для защиты металлических изделий от коррозии с помощью лакокрасочных покрытий: покрытие должно быть сплошным, газо- и водонепроницаемым, химически стойким, эластичным, обладать высоким сцеплением с материалом, механической прочностью, твердостью.
3. Химические способы.
Существует множество методов защиты металла, относящихся к этой группе. Одним из них является обработка поверхности веществами, вступающими с ней в химическую реакцию, в результате чего формируется пленка устойчивого химического соединения. Речь идет о таких способах как оксидирование, фосфатирование, сульфидирование, пр.
Оксидирование представляет собой способ защиты за счет образования оксидных пленок на поверхности металлических изделий.
Наиболее современным вариантом этого метода является химическая и электрохимическая обработка деталей в щелочных растворах.

Для железа и его сплавов наиболее часто используется щелочное оксидирование в растворе, содержащем NaOH, NaNO3, NaNO2 при температуре +135…+140 °С. Оксидирование черных металлов называется воронением.
Фосфатирование является методом формирования фосфатных пленок на изделиях из цветных и черных металлов. Для фосфатирования металлическое изделие погружают в растворы фосфорной кислоты и ее кислых солей (H3PO4 + Mn(H2PO4)2) при температуре +96…+98 °С.
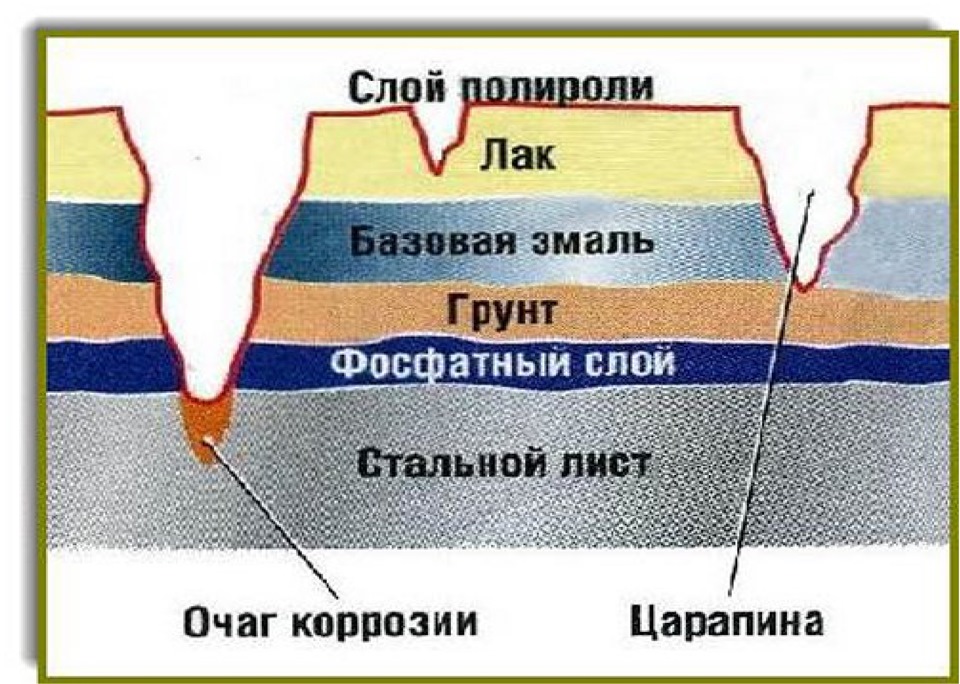
Фосфатная пленка оказывается химически связана с материалом изделия и состоит из сросшихся между собой кристаллов, разделенных порами ультрамикроскопических размеров. Главными достоинствами фосфатных пленок являются хорошая адгезия и развитая шероховатая поверхность. Благодаря этому, такие пленки становятся отличной основой для лакокрасочных покрытий и пропитывающих смазок. Обычно данный подход выбирают для защиты деталей от коррозии, когда те будут использоваться в закрытых помещениях, либо если изделие подвергнется последующей окраске или покрытию лаком. Однако у таких пленок есть свои минусы, в первую очередь к ним относятся низкая прочность и эластичность, хрупкость.
Анодированием называется защита поверхности металла при помощи формирования оксидных пленок, обычно данный способ используется для защиты алюминия. На поверхности этого металла всегда есть тонкая оксидная пленка Al2O3 или Al2O3 ×∙(H2O)n. Однако она не способна противостоять появлению ржавчины, поэтому в результате воздействия окружающей среды на алюминии постепенно образуется слой продуктов коррозии.
Для искусственного формирования оксидных пленок используют химический и электрохимический способы. Во втором случае алюминиевое изделие используется в качестве анода электролизера. Тогда как роль электролита играет раствор серной, ортофосфорной, хромовой, борной или щавелевой кислот. Катодом может быть металл, не вступающий в реакцию с раствором электролита, допустим, нержавеющая сталь. На катоде выделяется водород, за счет чего на аноде формируется оксид алюминия.
От точного выполнения при защите деталей от коррозии требований ГОСТа зависят надежность, сроки эксплуатации изделий. Не менее важно правильно выбрать метод обработки, принимая во внимание условия эксплуатации изделий, а также их изначальные характеристики. В результате удастся обеспечить надежную защиту от ржавчины, а изделие сможет служить значительно дольше, при этом использоваться по своему прямому назначению.
Почему следует обращаться именно к нам
Мы с уважением относимся ко всем клиентам и одинаково скрупулезно выполняем задания любого объема.
Наши производственные мощности позволяют обрабатывать различные материалы:
- цветные металлы;
- чугун;
- нержавеющую сталь.
При выполнении заказа наши специалисты применяют все известные способы механической обработки металла. Современное оборудование последнего поколения дает возможность добиваться максимального соответствия изначальным чертежам.
Для того чтобы приблизить заготовку к предъявленному заказчиком эскизу, наши специалисты используют универсальное оборудование, предназначенное для ювелирной заточки инструмента для особо сложных операций. В наших производственных цехах металл становится пластичным материалом, из которого можно выполнить любую заготовку.
Преимуществом обращения к нашим специалистам является соблюдение ими ГОСТа и всех технологических нормативов. На каждом этапе работы ведется жесткий контроль качества, поэтому мы гарантируем клиентам добросовестно выполненный продукт.
Благодаря опыту наших мастеров на выходе получается образцовое изделие, отвечающее самым взыскательным требованиям. При этом мы отталкиваемся от мощной материальной базы и ориентируемся на инновационные технологические наработки.
Мы работаем с заказчиками со всех регионов России. Если вы хотите сделать заказ на металлообработку, наши менеджеры готовы выслушать все условия. В случае необходимости клиенту предоставляется бесплатная профильная консультация.
SERD210T › Блог › Рыжий дьявол.

Как Вы уже поняли, речь пойдёт о ржавчине.
Итак, что же такое ржавчина (коррозия)?
В той или иной мере, на этот вопрос может ответить каждый из нас. В этом нет ничего удивительного, если вы и забыли этот материал из курса школьной программы, то окружающий мир предоставляет огромное количество наглядных примеров. Тем не менее, давайте обратимся к научному определению коррозии.
Корро́зия (от лат. corrosio — разъедание) — это самопроизвольное разрушение металлов в результате химического или физико-химического взаимодействия с окружающей средой. В общем случае это разрушение любого материала, будь то металл или керамика, дерево или полимер. Причиной коррозии служит термодинамическая неустойчивость конструкционных материалов к воздействию веществ, находящихся в контактирующей с ними среде.
Какая ОНА бывает?
Коррозионные процессы отличаются широким распространением и разнообразием условий и сред, в которых они протекают. Поэтому пока нет единой и всеобъемлющей классификации встречающихся случаев коррозии.
По типу агрессивных сред, в которых протекает процесс разрушения, коррозия может быть следующих видов:
• Газовая коррозия;
• Атмосферная коррозия;
• Коррозия в неэлектролитах;
• Коррозия в электролитах;
• Подземная коррозия;
• Биокоррозия;
• Коррозия блуждающим током.
По условиям протекания коррозионного процесса различаются следующие виды:
• Контактная коррозия;
• Щелевая коррозия;
• Коррозия при неполном погружении;
• Коррозия при полном погружении;
• Коррозия при переменном погружении;
• Коррозия при трении;
• Межкристаллитная коррозия
• Коррозия под напряжением.
По характеру разрушения:
• Сплошная коррозия, охватывающая всю поверхность;
• равномерная;избирательная.
• Локальная (местная) коррозия, охватывающая отдельные участки:
• пятнами;
• язвенная;
• точечная (или питтинг);
• сквозная;
• межкристаллитная.
Главная классификация производится по механизму протекания процесса. Различают два вида:
• химическую коррозию;
• электрохимическую коррозию.
Коррозия металла.
Образование гальванических пар с пользой применяют для создания батарей и аккумуляторов. С другой стороны, образование такой пары приводит к неблагоприятному процессу, жертвой которого становится целый ряд металлов — коррозии. Под коррозией понимают происходящее на поверхности электрохимическое или химическое разрушение металлического материала. Наиболее часто при коррозии металл окисляется с образованием ионов металла, которые при дальнейших превращениях дают различные продукты коррозии. Коррозия может быть вызвана как химическим, так и электрохимическим процессом. Соответственно, различают химическую и электрохимическую коррозию металлов.
Химическая коррозия.
Химическая коррозия — взаимодействие поверхности металла с (коррозионно-активной) средой, не сопровождающееся возникновением электрохимических процессов на границе фаз. В этом случае взаимодействия окисление металла и восстановление окислительного компонента коррозионной среды протекают в одном акте. Например, образование окалины при взаимодействии материалов на основе железа при высокой температуре с кислородом:
4Fe + 3O2 → 2Fe2O3
Электрохимическая коррозия.
Разрушение металла под воздействием возникающих в коррозионной среде гальванических элементов называют электрохимической коррозией. При электрохимической коррозии (наиболее частая форма коррозии) всегда требуется наличие электролита (конденсат, дождевая вода и т. д.) как, например, при ржавлении железа во влажной атмосфере:
4Fe + 3O2 + 6H2O → 4FeO(OH)•H2O
Электроды образуют либо различные элементы структуры материала, либо два различных соприкасающихся материала. Если в воде растворены ионы солей, электропроводность ее повышается, и скорость процесса увеличивается. Особо сильно действуют хлорид-ионы (содержащиеся, например в морской воде или в воде, образовавшейся при таянии снега зимой, когда дороги посыпают солью), так как они катализируют процесс коррозии. С получающимися в процессе коррозии Fe3+-ионами ионы хлора образуют растворимые комплексы (FeCl4-), что способствует ускорению окисления металла.
При соприкосновении двух металлов с различными окислительно-восстановительными потенциалами и погружении их в раствор электролита, например, дождевой воды с растворенным углекислым газом CO2, образуется гальванический элемент, так называемый, коррозионный элемент. Он представляет собой ни что иное, как замкнутую гальваническую ячейку. В ней происходит медленное растворение металлического материала с отрицательным окислительно-восстановительным потенциалом. Этот вид коррозии особо присущ металлам с высокими отрицательными потенциалами. Так, совсем небольшого количества примеси на поверхности металла с большим редокспотенциалом уже достаточно для возникновения коррозионного элемента. Особо подвержены риску места соприкосновения металлов с различными потенциалами, например, сварочные швы или заклёпки.
Этого материала вполне достаточно, чтобы иметь представления каким образом происходит процесс коррозии. А значит и почему ржавеет кузов вашего автомобиля.
Самые популярные «сказки» про ржавчину.
Сказка первая.
Новые автомобили не ржавеют.
Как сказал Генри Форд – самый лучший автомобиль – это новый автомобиль! В «народе говорят», что новые автомобили не ржавеют. Лет 5-10 можно катать на них, а потом продать. И кузов, если за ним следить, будет в идеальном состоянии.
Что можно противопоставить этой сказочке? Только факты, подкрепленные научными исследованиями. По данным Стокгольмского Института Коррозии, 40% новых автомобилей (начиная с 1998 г. выпуска) успели проржаветь так, что мало не покажется. И процесс коррозии начинается с первых минут, когда автомобиль выезжает со сборочного конвеера.
Сказка вторая.
Лак, краска и грунтовка защитят мою машину на долгие годы.
Сейчас машины такими красками красят, что никакая ржавчина им не страшна. Главное царапин не делать, не разрушать целостность лакокрасочного покрытия. А грунтовки, а лаки! Нет, лет 10 ничего с моей машиной не случиться!
Качество используемых лакокрасочных и грунтовочных материалов играет лишь незначительную роль в защите от коррозии, всего 20%! Со временем на любой лакокрасочной поверхности неизбежно образуются поры, капилляры, невидимые глазу микротрещины… Через них проникает кислород, влага, кислоты, щелочи. А значит, начинается процесс коррозии.
Кроме того, существует поверхностная коррозия металла, которой неважно наличие грунта и краски – повышенная коррозийная опасность частей кузова закладывается с первых минут их рождения.
И еще. Нагрузки – постоянное воздействие на автомобиль вызывает преждевременную усталость металла. Из-за этого разрушение “защитного” покрытия происходит значительно быстрее.
Так что, антикоррозийные покрытия – это лишь временная мера. Прикрывая поверхность металла, они не останавливают сам процесс коррозии. В итоге, ржавчина под слоем лако-красочного покрытия обнаруживается уже через недолгое время.
Сказка третья.
В гараже автомобиль защищен от коррозии.
Если машина в гараже стоит, она не верам ни дождю не доступна. Никакая ржавчина ей не страшна!
А вот и неправильно! Совсем наоборот! Гараж только усиливает процесс коррозии. Стены гаражей, особенно металлических, по отношению к автомобилю – аноду, являются катодом, еще более ускоряющим коррозийные процессы.
Сказка четвертая.
Оцинковка – панацея от ржавчины.
Если машина оцинкована, то ей вообще ржавчина не страшна! Хорошие производители все детали цинком покрывают. А железо покрытое цинком – вообще не ржавеет!
Ужасное заблуждение! Слой цинка настолько тонкий, что его защитных свойств в наших условиях хватает лишь на 1-2 сезона. Песчяно-соляная смесь из-под колес сдирает цинк как наждачная бумага. И не стоит обольщаться, что снаружи явной коррозии не видно – она уже начала делать свое “черное” дело там, внутри.
А после аварии любой автомобиль, как не грунтуй и не крась и каким “цинковым” он бы не был – уже не то. Появление жуков в недалеком будущем неизбежно. Ведь после кузовных работ – рихтовки, сварки в металле возникают напряженные участки и коррозия начинает прогрессировать ускоренными темпами.
МЕХАНИЗМ КОРРОЗИИ КУЗОВА АВТОМОБИЛЯ
Кузов любого автомобиля сделан из металла. Прежде чем пытаться защитить его от коррозии, необходимо ответить на вопрос о том, что такое коррозия металла. В быту коррозией называют появление ржавчины на поверхности металла. Из курса физики известно, что проводники характеризуются способностью отдавать электроны во внешнюю среду. Наглядно можно представить, что каждый проводник окружен облаком из электронов, которые под воздействием тепловой энергии вылетают из своих орбит, а затем, если им ничто не мешает, под действием электрических сил возвращаются в проводник. Если металл поместить в электролит, то положительные ионы металла (т.е. те атомы металла, электроны которых находятся во внешней среде) начнут переходить в электролит. В результате этого металл приобретает некоторый потенциал, который может быть измерен. Наибольший интерес представляет процесс коррозии железа в электролите при наличии менее активного металла. В этом случае железо как более активный металл является анодом, а менее активный – катодом. В гальванической паре всегда корродирует более активный металл – анод.
Коррозия анода сопровождается двумя видами реакций – окислительной на аноде и восстановительной на катоде. Таким образом, железо в сочетании с водой и менее активным металлом переходит в гидроокись железа, которая в обиходе называется ржавчиной.
Наличие в воде дополнительной соли приводит к повышению проводимости электролита и, как следствие, к увеличению окисления анода. При этом дополнительно образуются хлорное железо и раствор соляной кислоты.
Вот такие условия предоставляют автолюбителям каждую зиму наши дорожники. Впрочем, кислотные дожди, которые выпадают с осадками, также не способствуют долголетию автомобиля.
Важной характеристикой коррозии является скорость коррозии, которая определяется как глубина проникновения коррозии за единицу времени. Для железа наиболее характерным является значение скорости коррозии в пределах 0,05 — 0,02 мм в год. Из приведенных значений скорости коррозии следует, что при нарушении лакокрасочного покрытия за 5 лет эксплуатации автомобиля толщина металла может уменьшиться на 0,25-1,00 мм, т.е., по сути дела, если не предусмотреть специальных мер защиты металл проржавеет насквозь.
Описанный механизм коррозии указывает также на основные пути борьбы с этим явлением. Изолировать металл от электролита с помощью покрытия или превратить корпус автомобиля из анода в катод. Первый способ известен всем автолюбителям и широко используется на практике, однако он не прекращает коррозии как таковой, а только защищает металл от ржавления. При нарушении лакокрасочного покрытия коррозия начинает разъедать металл, а само нанесение покрытия сопряжено с большими временными и материальными затратами. Вместе с тем, не отрицая важности регулярного восстановления лакокрасочного покрытия, обращаем внимание на принципиально иной метод защиты корпуса автомобиля от коррозии, а именно, полное прекращение самого процесса коррозии путем изменения потенциала корпуса автомобиля с помощью устройства катодно-протекторной защиты.
Катодно-протекторная защита основана на том, что скорость коррозии пропорциональна активности металлов, образующих гальваническую пару. Установленный комплект катодно-протекторной защиты изменяет потенциал кузова автомобиля относительно внешней среды. Корпус автомобиля становится катодом и не корродирует вообще (по крайней мере скорость коррозии уменьшается в разы).
Важную роль в процессе коррозии играет неоднородность (на микроуровне) поверхности изделия.
На практике эта неоднородность может быть вызвана примесями (легирующие добавки), включениями (цементит Fe3C), границами зерен микрокристаллов железа, микротрещинами, различной степенью шероховатости поверхности и т. д. Из-за этого атомы железа на разных участках имеют различную способность отдавать электроны, т. е. окисляться, и в результате возникают гальванические элементы микроскопических размеров.
Участок металла, на котором протекает этот процесс, играет роль анода.
Соседние участки металла, обладающие другими свойствами, выполняют роль катода. Электроны, отданные атомами железа, по металлу переходят на эти участки и вызывают процесс восстановления. На катоде одновременно протекают процессы восстановления воды и растворенных в воде молекул кислорода:
H2O + 2e– = 2OH– + H2↑;
O2 + 2H2O + 4e– = 4OH–.
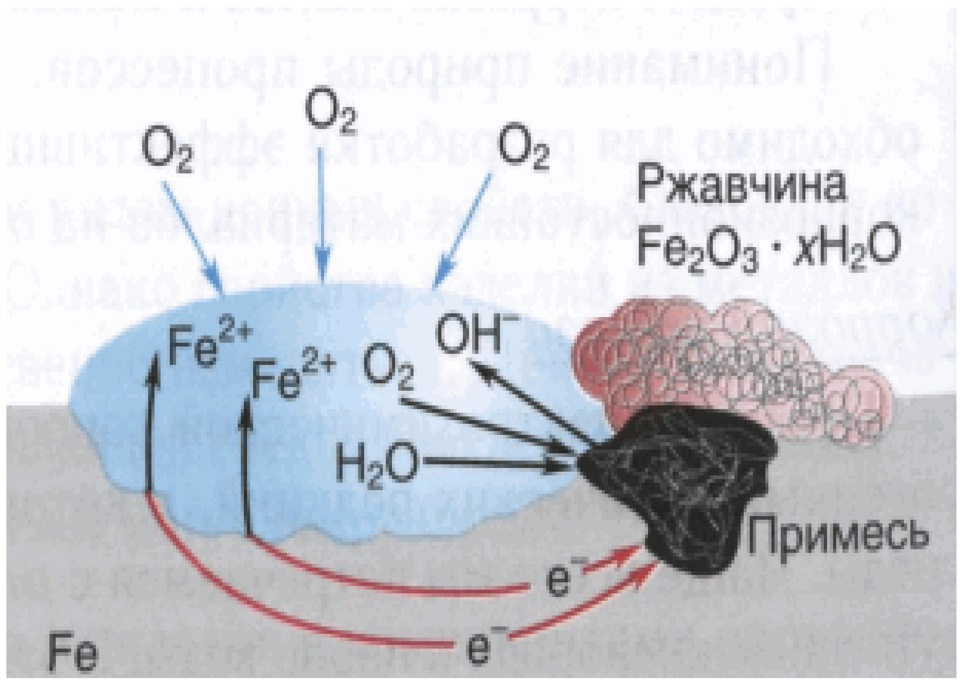
В конечном результате из ионов железа(II) и гидроксид-ионов образуется гидроксид железа(II), который далее окисляется до гидроксида железа(III) переменного состава, являющегося основным компонентом ржавчины. Упрощенно эти процессы можно выразить следующим образом:
Fe2+ + 2OH– = Fe(OH)2;
Fe(OH)2 + O2 + H2O → Fe2O3 • xH2O.
Если железное изделие привести в контакт с другим металлом, то в зависимости от его активности процесс коррозии либо ускоряется, либо замедляется.
Так, если второй металл является более активным, то процесс коррозии железа замедляется за счет коррозии более активного металла. Например, железо в контакте с цинком будет подвергаться коррозии значительно медленнее до тех пор, пока не разрушится весь цинк.
Если железо находится в контакте с менее активным металлом, то его коррозия резко усиливается. Например, железо в контакте с оловом подвергается коррозии значительно быстрее, чем чистое железо.
Так как медь стоит в ряду положительных металлов и разность потенциалов меди и железа значительна, то вместо защиты будет наблюдаться усиленное ржавление железа.
Это особенно актуально любителям залудить, запаять поражённые ржавчиной участки кузова машины.
ЭПИЛОГ.
Исходя из положения элемента в периодической системе, можно заранее сказать, какими химическими, а следовательно, и коррозионными свойствами он обладает. Под термином «коррозионные свойства» понимается, как легко данный элемент окисляется, какова устойчивость образующихся оксидов по отношению к воде, растворам солей и различных газов.
Так, в I группе в побочной подгруппе расположены металлы, весьма стойкие в коррозионном отношении. Это медь, серебро, золото, причем их коррозионная стойкость повышается с увеличением атомной массы.
Во II группе также более устойчивы металлы побочной подгруппы: цинк, кадмий, ртуть. На их поверхности в присутствии кислорода образуется тонкая, довольно прочная пленка оксидов, предохраняющая от дальнейшего процесса разрушения.
В III группе из технически важных металлов находится алюминий – это химически активный металл. Он легко окисляется кислородом воздуха, вследствие чего на его поверхности образуется тонкая стекловидная пленка. Но эта пленка обладает высокими защитными свойствами.
В IV группе находятся коррозионностойкие металлы – олово, свинец, стойкость которых тоже объясняется образованием прочных защитных пленок.
Металлы, находящиеся в четных рядах больших периодов, в V, VI и VII группах, обладают высокой способностью к пассивации, а следовательно, большой коррозийной стойкостью. Это ванадий, хром, кобальт и др.
Наиболее коррозионностойкие металлы находятся в VIII группе, причем чем больше их атомная масса, тем больше их устойчивость. Следовательно, из металлов VIII группы наиболее коррозионностойкие осмий, иридий и платина.
Коррозия приводит к техногенному засорению нашей планеты. В настоящее время на земном шаре ежегодно выплавляется более 0,7 млрд т стали, а уничтожается коррозией от 10 до 25% этой величины. Средняя продолжительность жизни стальных изделий составляет около 15 лет. Таков же средний возраст изделий из многих цветных и черных металлов.
Знаменитая Эйфелева башня (7,3 тыс. т металлических конструкций) давно была бы уничтожена коррозией, если бы каждые 7 лет ее не покрывали краской. На окраску уже затрачены средства, превышающие стоимость самого сооружения.
Коррозия, ржавчина, подобно ненасытному дракону, настоящему рыжему дьяволу, сжирает миллиарды тонн железа и приносит громадный ущерб во всех странах. Никакие предохранительные покрытия, смазки, лаки, краски, использование сплавов не могут предотвратить болезни металлов – окисление, распыление, ржавление.
Защита металла от коррозии
Металлы используются человеком с доисторических времен, изделия из них широко распространены в нашей жизни. Самым распространенным металлом является железо и его сплавы. К сожалению, они подвержены коррозии, или ржавлению — разрушению в результате окисления. Своевременная защита от коррозии позволяет продлить срок службы металлических изделий и конструкций.

Виды коррозии
Ученые давно борются с коррозией и выделили несколько основных ее типов:
- Атмосферная. Происходит окисление вследствие контакта с кислородом воздуха и содержащимися в нем водяными парами. Присутствие в воздухе загрязнений в виде химически активных веществ ускоряет ржавление.
- Жидкостная. Проходит в водной среде, соли, содержащиеся в воде, особенно морской, многократно ускоряют окисление.
- Почвенная. Этому виду подвержены изделия и конструкции, находящиеся в грунте. Химический состав грунта, грунтовые воды и токи утечки создают особую среду для развития химических процессов.
Исходя из того, в какой среде будет эксплуатироваться изделие, подбираются подходящие методы защиты от коррозии.
Характерные типы поражения ржавчиной
Различают следующие характерные виды поражения коррозией:
- Поверхность покрыта сплошным ржавым слоем или отдельными кусками.
- На детали возникли небольшие участки ржавчины, проникающей в толщину детали.
- В виде глубоких трещин.
- В сплаве окисляется один из компонентов.
- Глубинное проникновение по всему объему.
- Комбинированные.

Виды коррозионных разрушений
По причине возникновения разделяют также:
- Химическую. Химические реакции с активными веществами.
- Электрохимическую. При контакте с электролитическими растворами возникает электрический ток, под действием которого замещаются электроны металлов, и происходит разрушение кристаллической структуры с образованием ржавчины.
Коррозия металла и способы защиты от нее
Ученые и инженеры разработали множество способов защиты металлических конструкций от коррозии.
Защита от коррозии индустриальных и строительных конструкций, различных видов транспорта осуществляется промышленными способами.
Зачастую они достаточно сложные и дорогостоящие. Для защиты металлических изделий в условиях домовладений применяют бытовые методы, более доступные по цене и не связанные со сложными технологиями.
Промышленные
Промышленные методы защиты металлических изделий подразделяются на ряд направлений:
- Пассивация. При выплавке стали в ее состав добавляют легирующие присадки, такие, как Cr, Mo, Nb, Ni. Они способствуют образованию на поверхности детали прочной и химически стойкой пленки окислов, препятствующей доступу агрессивных газов и жидкостей к железу.
- Защитное металлическое покрытие. На поверхность изделия наносят тонкий слой другого металлического элемента — Zn , Al, Co и др. Этот слой защищает железо о т ржавления.
- Электрозащита. Рядом с защищаемой деталью размещают пластины из другого металлического элемента или сплава, так называемые аноды. Токи в электролите текут через эти пластины, а не через деталь. Так защищают подводные детали морского транспорта и буровых платформ.
- Ингибиторы. Специальные вещества, замедляющие или вовсе останавливающие химические реакции.
- Защитное лакокрасочное покрытие.
- Термообработка.

Порошковая покраска для защиты от коррозии
Способы защиты от коррозии, используемые в индустрии, весьма разнообразны. Выбор конкретного метода борьбы с коррозией зависит от условий эксплуатации защищаемой конструкции.
Бытовые
Бытовые методы защиты металлов от коррозии сводятся, как правило, к нанесению защитных лакокрасочных покрытий. Состав их может быть самый разнообразный, включая:
- силиконовые смолы;
- полимерные материалы;
- ингибиторы;
- мелкие металлические опилки.
Отдельной группой стоят преобразователи ржавчины — составы, которые наносят на уже затронутые коррозией конструкции. Они восстанавливают железо из окислов и предотвращают повторную коррозию. Преобразователи делятся на следующие виды:
- Грунты. Наносятся на зачищенную поверхность, обладают высокой адгезией. Содержат в своем составе ингибирующие вещества, позволяют экономить финишную краску.
- Стабилизаторы. Преобразуют оксиды железа в другие вещества.
- Преобразователи оксидов железа в соли.
- Масла и смолы, обволакивающие частички ржавчины и нейтрализующие ее.

При выборе грунта и краски лучше брать их от одного производителя. Так вы избежите проблем совместимости лакокрасочных материалов.
Защитные краски по металлу
По температурному режиму эксплуатации краски делятся на две большие группы:
- обычные, используемые при температурах до 80 °С;
- термостойкие.
По типу связующей основы краски бывают:
- алкидные;
- акриловые;
- эпоксидные.
Лакокрасочные покрытия по металлу имеют следующие достоинства:
- качественная защита поверхности от коррозии;
- легкость нанесения;
- быстрота высыхания;
- много разных цветов;
- долгий срок службы.
Большой популярностью пользуются молотковые эмали, не только защищающие метал, но и создающие эстетичный внешний вид. Для обработки металла распространена также краска-серебрянка. В ее состав добавлена алюминиевая пудра. Защита металла происходит за счет образования тонкой пленки окиси алюминия.

Эпоксидные смеси из двух компонентов отличаются исключительной прочностью покрытия и применяются для узлов, подверженных высоким нагрузкам.
Защита металла в бытовых условиях
Чтобы надежно защитить металлические изделия от коррозии, следует выполнить следующую последовательность действий:
- очистить поверхность от ржавчины и старой краски с помощью проволочной щетки или абразивной бумаги;
- обезжирить поверхность;
- сразу же нанести слой грунта;
- после высыхания грунта нанести два слоя основной краски.
При работе следует использовать средства индивидуальной защиты:
- перчатки;
- респиратор;
- очки или прозрачный щиток.
Способы защиты металлов от коррозии постоянно совершенствуются учеными и инженерами.
Методы противостояния коррозионным процессам
Основные методы, применяемые для противодействия коррозии, приведены ниже:
- повышение способности материалов противостоять окислению за счет изменения его химического состава;
- изоляция защищаемой поверхности от контакта с активными средами;
- снижение активности окружающей изделие среды;
- электрохимические.
Первые две группы способов применяются во время изготовления конструкции, а вторые – во время эксплуатации.
Методы повышения сопротивляемости
В состав сплава добавляют элементы, повышающие его коррозионную устойчивость. Такие стали называют нержавеющими. Они не требуют дополнительных покрытий и отличаются эстетичным внешним видом. В качестве добавок применяют никель, хром, медь, марганец, кобальт в определенных пропорциях.

Нержавеющая сталь AISI 304
Стойкость материалов к ржавлению повышают также, удаляя их состава ускоряющие коррозию компоненты, как, например, кислород и серу — из стальных сплавов, а железо – из магниевых и алюминиевых.
Снижение агрессивности внешней среды и электрохимическая защита
С целью подавления процессов окисления во внешнюю среду добавляют особые составы — ингибиторы. Они замедляют химические реакции в десятки и сотни раз.
Электрохимические способы сводятся к изменению электрохимического потенциала материала путем пропускания электрического тока. В результате коррозионные процессы сильно замедляются или даже вовсе прекращаются.
Пленочная защита
Защитная пленка препятствует доступу молекул активных веществ к молекулам металла и таким образом предотвращают коррозионные явления.
Пленки образуются из лакокрасочных материалов, пластмассы и смолы. Лакокрасочные покрытия недороги и удобны в нанесении. Ими покрывают изделие в несколько слоев. Под краску наносят слой грунта, улучшающего сцепление с поверхностью и позволяющего экономить более дорогую краску. Служат такие покрытия от 5 до 10 лет. В качестве грунта иногда применяют смесь фосфатов марганца и железа.
Защитные покрытия создают также из тонких слоев других металлов: цинка, хрома, никеля. Их наносят гальваническим способом.
Покрытие металлом с более высоким электрохимическим потенциалом, чем у основного материала, называется анодным. Оно продолжает защищать основной материал, отвлекая активные окислители на себя, даже в случае частичного разрушения. Покрытия с более низким потенциалом называют катодными. В случае нарушения такого покрытия оно ускоряет коррозию за счет электрохимических процессов.
Металлическое покрытие также можно наносить также методом распыления в струе плазмы.
Применяется также и совместный прокат нагретых до температуры пластичности листов основного и защищающего металла. Под давлением происходит взаимная диффузия молекул элементов в кристаллические решетки друг друга и образование биметаллического материала. Этот метод называют плакированием.