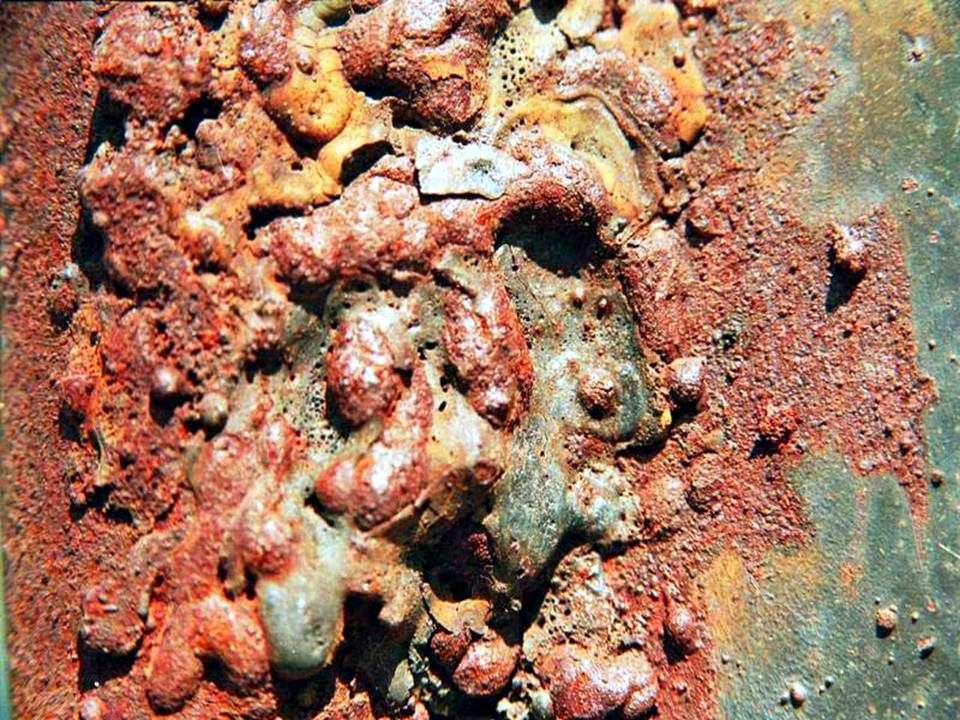
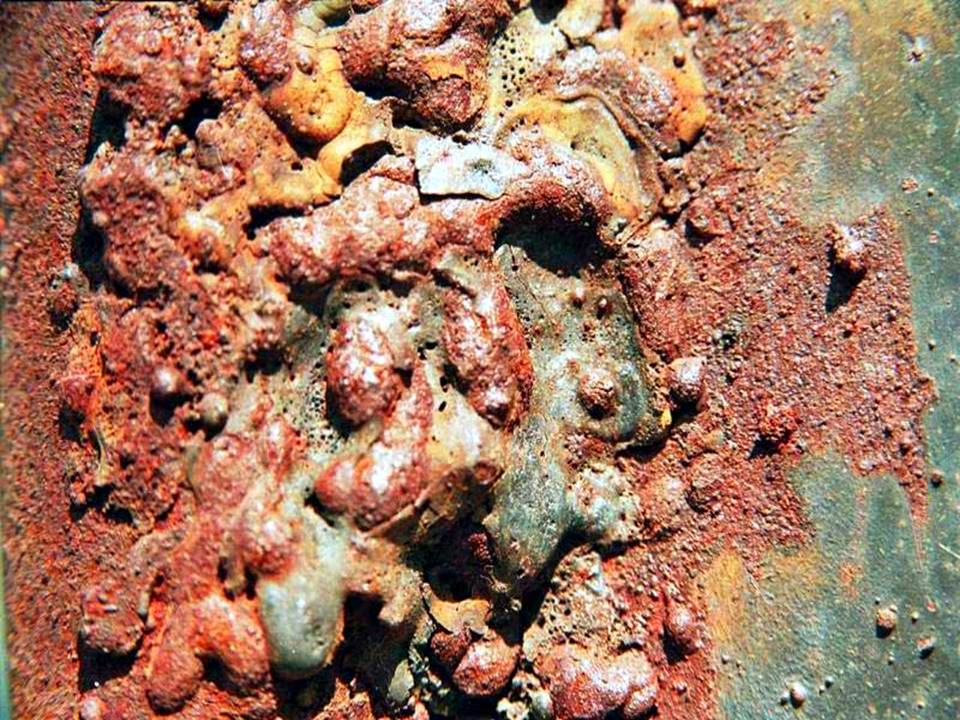
Коррозия – разрушение поверхности сталей и сплавов под воздействием различных физико-химических факторов – наносит огромный ущерб деталям и металлоконструкциям. Ежегодно этот невидимый враг «съедает» около 13 млн. т металла. Для сравнения – металлургическая промышленность стран Евросоюза в прошлом, 2014 году произвела всего на 0,5 млн. тонн больше. И это только – прямые потери. А длительная эксплуатация стальных изделий без их эффективной защиты от коррозии вообще невозможна.
Что такое коррозия и её разновидности
Основной причиной интенсивного окисления поверхности металлов (что и является основной причиной коррозии) являются:
- Повышенная влажность окружающей среды.
- Наличие блуждающих токов.
- Неблагоприятный состав атмосферы.
Соответственно этому различают химическую, трибохимическую и электрохимическую природу коррозии. Именно они в совокупности своего влияния и разрушают основную массу металла.
Химическая коррозия
Такой вид коррозии обусловлен активным окислением поверхности металла во влажной среде. Безусловным лидером тут является сталь (исключая нержавеющую). Железо, являясь основным компонентом стали, при взаимодействии с кислородом образует три вида окислов: FeO, Fe2O3 и Fe3O4. Основная неприятность заключается в том, что определённому диапазону внешних температур соответствует свой окисел, поэтому практическая защита стали от коррозии наблюдается только при температурах выше 10000С, когда толстая плёнка высокотемпературного оксида FeO сама начинает предохранять металл от последующего образования ржавчины. Это процесс называется воронением, и активно применяется в технике для защиты поверхности стальных изделий. Но это – частный случай, и таким способом активно защищать металл от коррозии в большинстве случаев невозможно.

Химическая коррозия активизируется при повышенных температурах. Склонность металлов к химическому окислению определяется значением их кислородного потенциала – способности к участию в окислительно-восстановительных реакциях. Сталь – ещё не самый худший вариант: интенсивнее её окисляются, в частности, свинец, кобальт, никель.
Электрохимическая коррозия
Эта разновидность коррозии более коварна: разрушение металла в данном случае происходит при совокупном влиянии воды и почвы на стальную поверхность (например, подземных трубопроводов). Влажный грунт, являясь слабощёлочной средой, способствует образованию и перемещению в почве блуждающих электрических токов. Они являются следствием ионизации частиц металла в кислородсодержащей среде, и инициирует перенос катионов металла с поверхности вовне. Борьба с такой коррозией усложняется труднодоступностью диагностирования состояния грунта в месте прокладки стальной коммуникации.
Электрохимическая коррозия возникает при окислении контактных устройств линий электропередач при увеличении зазоров между элементами электрической цепи. Помимо их разрушения, в данном случае резко увеличивается энергопотребление устройств.
Трибохимическая коррозия
Данному виду подвержены металлообрабатывающие инструменты, которые работают в режимах повышенных температур и давлений. Антикоррозионное покрытие резцов, пуансонов, фильер и пр. невозможно, поскольку от детали требуется высокая поверхностная твёрдость. Между тем, при скоростном резании, холодном прессовании и других энергоёмких процессах обработки металлов начинают происходить механохимические реакции, интенсивность которых возрастает с увеличением температуры на контактной поверхности «инструмент-заготовка». Образующаяся при этом окись железа Fe2O3 отличается повышенной твёрдостью, и поэтому начинает интенсивно разрушать поверхность инструмента.

Методы борьбы с коррозией
Выбор подходящего способа защиты поверхности от образования ржавчины определяется условиями, в которых работает данная деталь или конструкция. Наиболее эффективны следующие методы:
- Нанесение поверхностных атмосферостойких покрытий;
- Поверхностная металлизация;
- Легирование металла элементами, обладающими большей стойкостью к участию в окислительно-восстановительных реакциях;
- Изменение химического состава окружающей среды.
Механические поверхностные покрытия
Поверхностная защита металла может быть выполнена его окрашиванием либо нанесением поверхностных плёнок, по своему составу нейтральных к воздействию кислорода. В быту, а также при обработке сравнительно больших площадей (главным образом, подземных трубопроводов) применяется окраска. Среди наиболее стойких красок – эмали и краски, содержащие алюминий. В первом случае эффект достигается перекрытием доступа кислороду к стальной поверхности, а во втором – нанесением алюминия на поверхность, который, являясь химически инертным металлом, предохраняет сталь от коррозионного разрушения.
Положительными особенностями данного способа защиты являются лёгкость его реализации и сравнительно небольшие финансовые затраты, поскольку процесс достаточно просто механизируется. Вместе с тем долговечность такого способа защиты невелика, поскольку, не обладая большой степенью сродства с основным металлом, такие покрытия через некоторое время начинают механически разрушаться.

Химические поверхностные покрытия
Коррозионная защита в данном случае происходит вследствие образования на поверхности обрабатываемого металла химической плёнки, состоящей из компонентов, стойких к воздействию кислорода, давлений, температур и влажности. Например, углеродистые стали обрабатывают фосфатированием. Процесс может выполняться как в холодном, так и в горячем состоянии, и заключается в формировании на поверхности металла слоя из фосфатных солей марганца и цинка. Аналогом фосфатированию выступает оксалатирование – процесс обработки металла солями щавелевой кислоты. Применением именно таких технологий повышают стойкость металлов от трибохимической коррозии.
Недостатком данных методов является трудоёмкость и сложность их применения, требующая наличия специального оборудования. Кроме того, конечная поверхность изменяет свой цвет, что не всегда приемлемо по эстетическим соображениям.
Легирование и металлизация
В отличие от предыдущих способов, здесь конечным результатом является образование слоя металла, химически инертного к воздействию кислорода. К числу таких металлов относятся те, которые на линии кислородной активности находятся возможно дальше от водорода. По мере возрастания эффективности этот ряд выглядит так: хром→медь→цинк→серебро→алюминий→платина. Различие в технологиях получения таких антикоррозионных слоёв состоит в способе их нанесения. При металлизации на поверхность направляется ионизированный дуговой поток мелкодисперсного напыляемого металла, а легирование реализуется в процессе выплавки металла, как следствие протекания металлургических реакций между основным металлом и вводимыми легирующими добавками.

Изменение состава окружающей среды
В некоторых случаях существенного снижения коррозии удаётся добиться изменением состава атмосферы, в которой работает защищаемая металлоконструкция. Это может быть вакуумирование (для сравнительно небольших объектов), или работа в среде инертных газов (аргон, неон, ксенон). Данный метод весьма эффективен, однако требует дополнительного оборудования — защитных камер, костюмов для обслуживающего персонала и т.д. Используется он главным образом, в научно-исследовательских лабораториях и опытных производствах, где специально поддерживается необходимый микроклимат.
Кто нам мешает, тот нам поможет
В завершение укажем и на довольно необычный способ коррозионной защиты: с помощью самих окислов железа, точнее, одного из них — закиси-окиси Fe3O4. Данное вещество образуется при температурах 250…5000С и по своим механическим свойствам представляет собой высоковязкую технологическую смазку. Присутствуя на поверхности заготовки, Fe3O4 перекрывает доступ кислороду воздуха при полугорячей деформации металлов и сплавов, и тем самым блокирует процесс зарождения трибохимической коррозии. Это явление используется при скоростной высадке труднодеформируемых металлов и сплавов. Эффективность данного способа обусловлена тем, что при каждом технологическом цикле контактные поверхности обновляются, а потому стабильность процесса регулируется автоматически.
Коррозия металлов. Виды коррозии металлов
Материалы из металлов под химическим или электрохимическим воздействием окружающей среды подвергаются разрушению, которое называется коррозией. Коррозия металлов вызывается окислительно-восстановительными реакциями, в результате которых металлы переходят в окисленную форму и теряют свои свойства, что приводит в негодность металлические материалы.
Можно выделить 3 признака, характеризующих коррозию:
- Коррозия – это с химической точки зрения процесс окислительно-восстановительный.
- Коррозия – это самопроизвольный процесс, возникающий по причине неустойчивости термодинамической системы металл – компоненты окружающей среды.
- Коррозия – это процесс, который развивается в основном на поверхности металла. Однако, не исключено, что коррозия может проникнуть и вглубь металла.
Виды коррозии металлов
Наиболее часто встречаются следующие виды коррозии металлов:
- Равномерная – охватывает всю поверхность равномерно
- Неравномерная
- Избирательная
- Местная пятнами – корродируют отдельные участки поверхности
- Язвенная (или питтинг)
- Точечная
- Межкристаллитная – распространяется вдоль границ кристалла металла
- Растрескивающая
- Подповерхностная
 Основные виды коррозии
Основные виды коррозии
С точки зрения механизма коррозионного процесса можно выделить два основных типа коррозии: химическую и электрохимическую.
Химическая коррозия металлов
Химическая коррозия металлов — это результат протекания таких химических реакций, в которых после разрушения металлической связи, атомы металла и атомы, входящие в состав окислителей, образуют химическую связь. Электрический ток между отдельными участками поверхности металла в этом случае не возникает. Такой тип коррозии присущ средам, которые не способны проводить электрический ток – это газы, жидкие неэлектролиты.
Химическая коррозия металлов бывает газовой и жидкостной.
Газовая коррозия металлов – это результат действия агрессивных газовых или паровых сред на металл при высоких температурах, при отсутствии конденсации влаги на поверхности металла. Это, например, кислород, диоксид серы, сероводород, пары воды, галогены. Такая коррозия в одних случаях может привести к полному разрушению металла (если металл активный), а в других случаях на его поверхности может образоваться защитная пленка (например, алюминий, хром, цирконий).
Жидкостная коррозия металлов– может протекать в таких неэлектролитах, как нефть, смазочные масла, керосин и др. Этот тип коррозии при наличии даже небольшого количества влаги, может легко приобрести электрохимический характер.
При химической коррозии скорость разрушения металла пропорциональна скорости химической реакции и той скорости с которой окислитель проникает сквозь пленку оксида металла, покрывающую его поверхность. Оксидные пленки металлов могут проявлять или не проявлять защитные свойства, что определяется сплошностью.
Сплошность такой пленки оценивают величине фактора Пиллинга—Бэдвордса: (α = Vок/VМе) по отношению объема образовавшегося оксида или другого какого-либо соединения к объему израсходованного на образование этого оксида металла
где Vок — объем образовавшегося оксида
VМе — объем металла, израсходованный на образование оксида
Мок – молярная масса образовавшегося оксида
ρМе – плотность металла
n – число атомов металла
AMe — атомная масса металла
ρок — плотность образовавшегося оксида
Оксидные пленки, у которых α 2,5 условие сплошности уже не соблюдается, вследствие чего такие пленки не защищают металл от разрушения.
Ниже представлены значения α для некоторых оксидов металлов
| металл | оксид | α | металл | оксид | α |
| K | K2O | 0,45 | Zn | ZnO | 1,55 |
| Na | Na2O | 0,55 | Ag | Ag2O | 1,58 |
| Li | Li2O | 0,59 | Zr | ZrO2 | 1.60 |
| Ca | CaO | 0,63 | Ni | NiO | 1,65 |
| Sr | SrO | 0,66 | Be | BeO | 1,67 |
| Ba | BaO | 0,73 | Cu | Cu2O | 1,67 |
| Mg | MgO | 0,79 | Cu | CuO | 1,74 |
| Pb | PbO | 1,15 | Ti | Ti2O3 | 1,76 |
| Cd | CdO | 1,21 | Cr | Cr2O3 | 2,07 |
| Al | Al2O2 | 1,28 | Fe | Fe2O3 | 2,14 |
| Sn | SnO2 | 1,33 | W | WO3 | 3,35 |
| Ni | NiO | 1,52 |
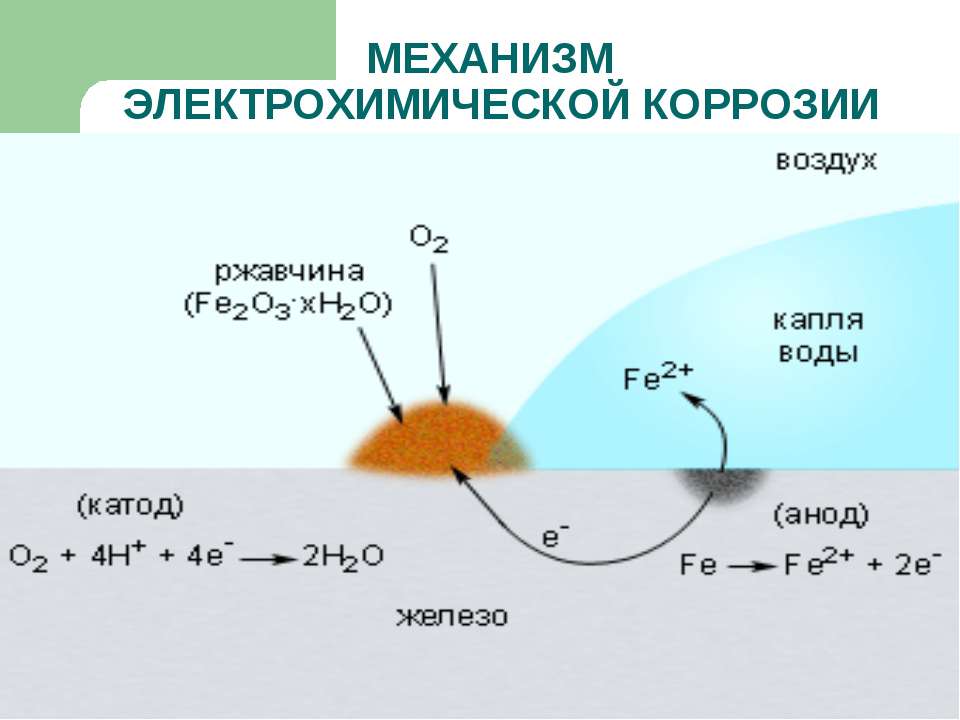
Электрохимическая коррозия металлов
Электрохимическая коррозия металлов – это процесс разрушения металлов в среде различных электролитов, который сопровождается возникновением внутри системы электрического тока.
При таком типе коррозии атом удаляется из кристаллической решетки результате двух сопряженных процессов:
- Анодного – металл в виде ионов переходит в раствор.
- Катодного – образовавшиеся при анодном процессе электроны, связываются деполяризатором (вещество — окислитель).
Сам процесс отвода электронов с катодных участков называется деполяризацией, а вещества способствующие отводу – деполяризаторами.
Наибольшее распространение имеет коррозия металлов с водородной и кислородной деполяризацией.
Водородная деполяризация осуществляется на катоде при электрохимической коррозии в кислой среде
2H + +2e — = H2 разряд водородных ионов
Кислородная деполяризация осуществляется на катоде при электрохимической коррозии в нейтральной среде
O2 + 4H + +4e — = H2O восстановление растворенного кислорода
Все металлы, по их отношению к электрохимической коррозии, можно разбить на 4 группы, которые определяются величинами их стандартных электродных потенциалов:
- Активные металлы (высокая термодинамическая нестабильность) – это все металлы, находящиеся в интервале щелочные металлы — кадмий (Е 0 = -0,4 В). Их коррозия возможна даже в нейтральных водных средах, в которых отсутствуют кислород или другие окислители.
- Металлы средней активности (термодинамическая нестабильность) – располагаются между кадмием и водородом (Е 0 = 0,0 В). В нейтральных средах, в отсутствии кислорода, не корродируют, но подвергаются коррозии в кислых средах.
- Малоактивные металлы (промежуточная термодинамическая стабильность) – находятся между водородом и родием (Е 0 = +0,8 В). Они устойчивы к коррозии в нейтральных и кислых средах, в которых отсутствует кислород или другие окислители.
- Благородные металлы (высокая термодинамическая стабильность) – золото, платина, иридий, палладий. Могут подвергаться коррозии лишь в кислых средах при наличии в них сильных окислителей.
Электрохимическая коррозия может протекать в различных средах. В зависимости от характера среды выделяют следующие виды электрохимической коррозии:
- Коррозия в растворах электролитов — в растворах кислот, оснований, солей, в природной воде.
- Атмосферная коррозия – в атмосферных условиях и в среде любого влажного газа. Это самый распространенный вид коррозии.
Например, при взаимодействии железа с компонентами окружающей среды, некоторые его участки служат анодом, где происходит окисление железа, а другие – катодом, где происходит восстановление кислорода:
А: Fe – 2e — = Fe 2+
Катодом является та поверхность, где больше приток кислорода.
- Почвенная коррозия – в зависимости от состава почв, а также ее аэрации, коррозия может протекать более или менее интенсивно. Кислые почвы наиболее агрессивны, а песчаные – наименее.
- Аэрационная коррозия — возникает при неравномерном доступе воздуха к различным частям материала.
- Морская коррозия – протекает в морской воде, в связи с наличием в ней растворенных солей, газов и органических веществ.
- Биокоррозия – возникает в результате жизнедеятельности бактерий и других организмов, вырабатывающих такие газы как CO2, H2S и др., способствующие коррозии металла.
- Электрокоррозия – происходит под действием блуждающих токов на подземных сооружениях, в результате работ электрических железных дорог, трамвайных линий и других агрегатов.
Методы защиты от коррозии металла
Основной способ защиты от коррозии металла – это создание защитных покрытий – металлических, неметаллических или химических.
Металлические покрытия.
Металлическое покрытие наносится на металл, который нужно защитить от коррозии, слоем другого металла, устойчивого к коррозии в тех же условиях. Если металлическое покрытие изготовлено из металла с более отрицательным потенциалом (более активный) , чем защищаемый, то оно называется анодным покрытием. Если металлическое покрытие изготовлено из металла с более положительным потенциалом (менее активный), чем защищаемый, то оно называется катодным покрытием.
Например, при нанесении слоя цинка на железо, при нарушении целостности покрытия, цинк выступает в качестве анода и будет разрушаться, а железо защищено до тех пор, пока не израсходуется весь цинк. Цинковое покрытие является в данном случае анодным.
Катодным покрытием для защиты железа, может, например, быть медь или никель. При нарушении целостности такого покрытия, разрушается защищаемый металл.
Неметаллические покрытия.
Такие покрытия могут быть неорганические (цементный раствор, стекловидная масса) и органические (высокомолекулярные соединения, лаки, краски, битум).
Химические покрытия.
В этом случае защищаемый металл подвергают химической обработке с целью образования на поверхности пленки его соединения, устойчивой к коррозии. Сюда относятся:
оксидирование – получение устойчивых оксидных пленок (Al2O3, ZnO и др.);
азотирование – поверхность металла (стали) насыщают азотом;
воронение стали – поверхность металла взаимодействует с органическими веществами;
цементация – получение на поверхности металла его соединения с углеродом.
Изменение состава технического металла также способствует повышению стойкости металла к коррозии. В этом случае в металл вводят такие соединения, которые увеличивают его коррозионную стойкость.
Изменение состава коррозионной среды (введение ингибиторов коррозии или удаление примесей из окружающей среды) тоже является средством защиты металла от коррозии.
Электрохимическая защита основывается на присоединении защищаемого сооружения катоду внешнего источника постоянного тока, в результате чего оно становится катодом. Анодом служит металлический лом, который разрушаясь, защищает сооружение от коррозии.
Протекторная защита – один из видов электрохимической защиты – заключается в следующем.
К защищаемому сооружению присоединяют пластины более активного металла, который называется протектором. Протектор – металл с более отрицательным потенциалом – является анодом, а защищаемое сооружение – катодом. Соединение протектора и защищаемого сооружения проводником тока, приводит к разрушению протектора.
MaxJeremin › Блог › Коррозия автомобиля в процессе эксплуатации. Методы защиты (очень много букв)

Химическая коррозия металлов протекает в сухих газах и неэлектролитах, т. е. в тех средах, которые не проводят электрический ток. Примером химической коррозии является газовая коррозия выпускного тракта автомобильного двигателя при взаимодействии металла с отработавшими газами в зоне высоких температур.
Электрохимическая коррозия протекает при соприкосновении металла с электролитом. При электрохимической коррозии возникает электрический ток, который протекает как в металле, так и в растворе электролита, образующих замкнутую цепь, подобно короткозамкнутому гальваническому элементу. Электрохимическая коррозия охватывает все виды коррозионного разрушения автомобиля, среди которых наибольшее распространение имеет атмосферная коррозия.
Незащищенная поверхность металла адсорбирует из окружающей среды окислительные компоненты — молекулы кислорода, оксидов углерода и серы, хлора и другие. Образуется оксидная пленка, которая на воздухе всегда содержит конденсированную влагу. Толщина пленки может быть различной в зависимости от температуры, влажности воздуха и других атмосферных условий. В условиях сухой атмосферы происходит химическое взаимодействие металлах кислородом и другими газообразными реагентами из воздуха. Как правило, сухая атмосферная коррозия приводит к потускнению поверхности металла, не вызывая его разрушения. Железо и сталь в сухой атмосфере не корродируют даже при наличии агрессивных газов.
При увеличении влажности атмосферы толщина пленки влаги увеличивается, омическое сопротивление пленки уменьшается, и при некотором минимальном его значении начинается коррозия, протекающая по электрохимическому механизму.
Под пленкой влаги на поверхности металла, как правило, образуются анодные и катодные участки, так как практически любая металлическая поверхность электрохимически неоднородна. Причинами электрохимической неоднородности могут быть микро- и макровключения, структурная неоднородность металла, наличие неравномерных пленок адсорбированных веществ, неравномерность деформации металла и внутренние напряжения, различие в температуре отдельных участков поверхности и многие другие. Таким образом, поверхность корродирующего металла представляет собой множество постоянно работающих гальванических элементов, при этом разрушаются анодные участки поверхности.
Одним из основных факторов, определяющих скорость атмосферной коррозии, является влажность воздуха. Критическая влажность, при которой сухая атмосферная коррозия переходит во влажную, протекающую по электрохимическому механизму, зависит от состояния поверхности металла и от наличия загрязнений в воздухе. Так, для чистой поверхности железа в условиях отсутствия загрязнений воздуха критическая влажность равна примерно 70 %. При наличии на поверхности пыли и грязи она снижается до 50 %. Это объясняется тем, что мелкие твердые частицы служат центрами конденсации влаги, а крупные — сами адсорбируют влагу.
Дальнейшее увеличение влажности воздуха, а также повышение температуры приводят к возрастанию скорости атмосферной коррозии. Поэтому теплый гараж для невысушенного автомобиля представляет собой «влажную камеру», благоприятствующую коррозии. В обогреваемых и плохо вентилируемых гаражах автомобиль ржавеет быстрее, чем в необогреваемых и хорошо вентилируемых. При температурах ниже точки замерзания пленки влаги процесс электрохимической коррозии тормозится.
Большое значение имеют колебания температуры во времени в связи с конденсацией и повторным испарением влаги на поверхности металла. — Так, даже при небольших суточных перепадах температуры в закрытых профилях автомобиля конденсируется влага. Конденсат практически не высыхает из-за недостаточной аэрации.
Атмосферная коррозия значительно усиливается различными примесями, которыми почти всегда загрязнен воздух. Источники загрязнения воздуха могут быть как естественными, так и искусственными. Естественные — это продукты выветривания горных пород, солончаков, почвы, растений, испарения водоемов. К искусственным относятся отходы промышленных предприятий, топок, двигателей внутреннего сгорания, транспортных средств и другие.
За последние десятилетия в 2—2,5 раза возросло количество сжигаемого топлива, в 10—15 раз — производство различных химических материалов, таких как минеральные удобрения, серная кислота, искусственные волокна, при котором образуется большое количество агрессивных газов, паров и сточных вод. Положение усугубляется все увеличивающимся количеством выхлопных газов автомобилей.
В промышленных районах дождевая вода имеет, как правило, кислую реакцию. Это связано с тем, что находящиеся в промышленной атмосфере газообразные примеси растворяются в дождевой воде и подкисляют ее.
Из промышленных загрязнений воздуха наиболее заметную роль играет диоксид серы (сернистый газ). Даже при содержании его в воздухе менее 0,0001 % наблюдается ускорение коррозии металлов.
При повышении содержания диоксида серы увеличивается и скорость коррозии. Аналогичное влияние на скорость коррозии оказывают хлор, аммиак, оксиды азота и другие газообразные примеси в атмосфере.
Из естественных загрязнений воздуха самым распространенным является тонкодисперсный аэрозоль хлорида натрия в атмосфере приморских районов. Корродирующее действие соли не пропорционально ее концентрации в электролите. Резкое возрастание коррозии наблюдается при малых содержаниях (до 1 %). Из этого следует, что даже небольшое содержание соли в пленке электролита на поверхности металла может быть причиной значительной коррозии.
Помимо перечисленных факторов, определяющих скорость атмосферной коррозии автомобиля, большое значение имеют всевозможные загрязнения, оседающие на кузове, деталях и в элементах полых конструкций. Источниками таких загрязнений являются пыль в воздухе, грязь и химические средства против обледенения на дорогах. Вблизи промышленных предприятий, особенно вблизи химических заводов, пыль и грязь на дорогах могут содержать значительное количество агрессивных веществ — сульфатов, хлоридов, фосфатов, угольной пыли и других.
Пыль проникает в закрытые сечения кузова, щели и зазоры и накапливается там. При последующем увлажнении она образует коррозионно-активную среду. Грязь, прилипающая к днищу кузова автомобиля, даже в сухие периоды остается влажной, и коррозия продолжается за счет влаги, находящейся в грязи.
Одним из существенных факторов, способствующих коррозии автомобилей в зимнее время, является применение химических средств борьбы против обледенения дорог, позволяющих достигнуть необходимых условий безопасности движения на зимних дорогах. Самые распространенные средства против обледенения — хлориды натрия и кальция. Общее количество соли, разбрасываемой на дорогах, за последние десятилетия значительно возросло. Расход соли на проезжей части достигает 4—5 кг на 1 м2. Попадание соли вместе с водой и снегом в трудно-промываемые элементы конструкции ускоряет коррозию кузова.
Скорость атмосферной коррозии автомобиля может меняться на несколько порядков в зависимости от климатических характеристик района, сезона года и условий эксплуатации.точечную или питтинговую коррозию — диаметр поражения меньше его глубины;
По характеру развития коррозия на металлической поверхности может быть сплошной или местной. Сплошная коррозия развивается на больших плохо защищенных поверхностях. Местная коррозия поражает поверхность металла на отдельных участках.
По виду коррозионного поражения металла местную коррозию можно разделить на:коррозию пятнами — диаметр поражения больше глубины;
язвенную коррозию — диаметр и глубина поражения примерно одинаковые;усталостная — в местах, подверженных одновременному воздействию агрессивной среды и знакопеременных нагрузок;
контактная — в местах контакта разнородных металлов; .
щелевая — в узких щелях и зазорах;
подпленочная — под лакокрасочными и полимерными покрытиями.
сквозную коррозию.
Различают также виды местной коррозии по ее локализации в конструкции автомобиля:
Последние два вида коррозии являются наиболее распространенными при эксплуатации автомобилей.
Щелевая коррозия развивается в узких зазорах и щелях, в которых происходит усиленная капиллярная конденсация влаги, фиксируются дорожные загрязнения. Разрушение происходит на анодных участках поверхности, находящихся внутри щели. Наружные участки щелевого соединения со свободным доступом кислорода воздуха играют роль катода. Скрытый характер щелевой коррозии не позволяет выявить ее на ранних стадиях, что может привести к значительным коррозионным повреждениям.
Подпленочная коррозия может проявляться в виде отдельных вздутий лакокрасочного покрытия или в виде паутинообразной сети нитей под покрытием — так называемая нитевидная коррозия. В этих случаях продукты коррозии металла, как правило, не поступают на поверхности покрытия, что затрудняет визуальное обнаружение очага коррозии. Нитевидная коррозия достаточно быстро растет от центра очага коррозии во всех направлениях, не вызывая глубоких разрушений металла, в центре очага металл разрушается вглубь, вплоть до сквозного поражения.
Подпленочная коррозия развивается также в местах механических повреждений лакокрасочных покрытий. Через сколы, царапины, микро- и макротрещины в покрытии влага и атмосферные загрязнения получают доступ к поверхности металла. Эти участки становятся анодными по отношению к примыкающей поверхности, и разрушение металла происходит достаточно быстро, образуя видимые продукты коррозии — ржавчину. Анодными участками могут быть также поверхности с уменьшенной толщиной лакокрасочного покрытия, даже при отсутствии его дефектов! Подпленочная коррозия в этих случаях протекает медленнее.
По степени поражения коррозию, встречающуюся на автомобилях, можно условно разделить на три основных типа — косметическая, проникающая и структурная.
Косметическая коррозия появляется на наружных, видимых поверхностях. Она ухудшает внешний вид автомобиля, но не влияет на его эксплуатационные качества. Однако, если не принять своевременных мер:, косметическая коррозия может развиться в проникающую.
Проникающая коррозия чаще всего развивается со стороны труднодоступных для визуального контроля поверхностей конструкций в местах скопления на них грязи и влаги. В этих случаях коррозия становится заметной только тогда, когда причиненный ею ущерб трудно исправить.
Структурная коррозия — потеря первоначальной жесткости и прочности конструкции в результате коррозионного разрушения силовых элементов, составляющих несущую структуру изделия.
Эти три типа коррозии характеризуют коррозионное разрушение кузова, которое приносит наибольший ущерб при эксплуатации автомобилей. Кузов является самой дорогостоящей и труднозаменимой частью автомобиля, так как на нем установлены все основные узлы и детали автомобиля. В то же время кузов более уязвим в коррозионном отношении, чем механические детали и узлы автомобиля, так как имеет пространственно развитую структуру с большой поверхностью, труднодоступными для обработки полостями и множеством щелей и зазоров в сварных и зафланцованных соединениях.
В первую очередь, как правило, косметическая коррозия появляется в местах сопряжения кузова с накладными деталями — молдингами, фонарями, ручками, замками, решеткой радиатора. Наиболее подвержены косметической коррозии также кромки металла на фланцах дверей, капота и крышки багажника, на водосточных желобах и других деталях кузова. Кромки металла, а также места точек сварки панелей кузова наименее защищены лакокрасочным покрытием из-за наличия микрозаусенцев и выплесков металла, образующихся при резке и сварке листового металла.
В зависимости от конструктивных особенностей, а также от условий транспортирования, хранения и эксплуатации автомобилей косметическая коррозия на кузовах может появляться в первые месяцы после выпуска автомобиля. Срок до появления первых очагов коррозии может быть от нескольких месяцев до нескольких лет.
В процессе эксплуатации автомобиля косметическая коррозия неизбежно появляется в местах растрескивания и механических повреждений лакокрасочных покрытий, чаще всего на лицевых панелях ниже поясной линии, подверженных при движении автомобиля «обстрелу» гравием и щебнем.
Проникающая коррозия кузова со стороны внутренних поверхностей чаще всего встречается на передних крыльях, в порогах и других коробчатых сечениях нижней части кузова, в нижней части панелей дверей. Полости, из которых развивается проникающая коррозия, труднодоступны для окраски и антикоррозионной обработки.
Структурная коррозия развивается на кузове в местах крепления силовых агрегатов, в элементах жесткости кузова, работающих при больших знакопеременных нагрузках. Наиболее подвержены структурной коррозии элементы днища кузова. На днище сосредоточена большая часть крепления силовых агрегатов. В то же время днище подвержено наибольшему абразивно-коррозионному воздействию. Потеря жесткости в конструкции кузова может привести к его деформации и смещению закрепленных на нем узлов, что делает дальнейшую эксплуатацию автомобиля невозможной.
В условиях сильного коррозионного воздействия находятся также все подкузовные узлы и детали: задняя и передняя подвески, трансмиссия и другие. Однако, благодаря тому что они изготовлены из металла значительной толщины, коррозия снаружи не приводит к ухудшению их эксплуатационных характеристик, но может вызывать потерю товарного вида автомобиля еще в предпродажный период.
Значительно более опасны коррозионные поражения внутренних поверхностей гидравлических систем тормозов, сцепления и систем охлаждения. Такие системы бывают обычно закрытыми, и защита их от коррозии обеспечивается применением ингибиторов коррозии в рабочих жидкостях, а также своевременной заменой последних.
При конструировании автомобилей наряду с выполнением таких требований, как минимальная собственная масса при высоких конструкционной жесткости и грузоподъемности, минимальные стоимость изготовления и материалоемкость при высоких потребительских свойствах и комфортабельности, необходимо обеспечить эффективную антикоррозионную защиту автомобиля. Зачастую при конструировании не удается с равным успехом удовлетворить все требования из-за их противоречивости.
Подавляющее большинство деталей и узлов современного массового легкового автомобиля изготавливается из некоррозионностойких сталей и нуждается в нанесении тех или иных защитных покрытий. Модели автомобилей различных марок имеют различные конструктивные особенности, от которых зависят затраты на обеспечение коррозионной стойкости. Так, объем затрат на антикоррозионную защиту кузова определяется площадью его поверхности, общей протяженностью сварных швов и фланцевых соединений, количеством и доступностью для обработки скрытых полостей.
Технология и материалы, применяемые различными автомобильными заводами для выполнения антикоррозионной защиты, неодинаковы. Конструктивные особенности, уровень защитных свойств антикоррозионных материалов, объем и эффективность технологии их нанесения определяют коррозионную стойкость автомобиля в целом.
Наряду с этим срок службы автомобиля существенно зависит от проведения профилактических противокоррозионных мероприятий в процессе эксплуатации автомобиля. Своевременность и квалифицированное выполнение указанных мероприятий в конечном счете сокращает материальные затраты владельца на ремонт и восстановление автомобиля по причине коррозионных нарушений.
В процессе изготовления легковых автомобилей на заводах и в процессе эксплуатации автомобилей проблемы защиты от коррозии решаются комплексно с использованием различных средств и методов, в том числе с использованием химических материалов (лакокрасочных материалов).
Борьба с коррозией: методы защиты металлических конструкций
![]()
Металл — это материал, который не имеет аналогов в мире по своим качествам, прочности, долговечности, и, что немаловажно, стоимости. Однако, у него есть один недостаток, который может свести на нет все выгоды от его использования. Беззащитный металл, подверженный воздействию природных осадков, химических реагентов, воды и других катаклизмов часто подвергается коррозии, или как говорят в простонародье, “ржавчине”. Все вы видели старые автомобили, за которыми не ухаживает хозяин — они прогнивают насквозь и иногда страшно подумать, что на этом транспорте еще передвигаются люди. Коррозия проедает металл насквозь, и, если не озаботиться заранее о том, чтобы защитить свое имущество от коррозии, то вы рискуете с ним расстаться намного раньше срока. В статье я расскажу, как защитить металл от ржавчины и продлить срок службы металлического изделия.
Причины возникновения коррозии
Начну статью с пояснения причин возникновения коррозии. Коррозия металла – серьезная проблема, но знание причин поможет не допустить распространения заразы.
- Самой распространенной причиной возникновения коррозии металла является электрохимическая – ситуация, когда металл соприкасается с влажной средой. Электрохимическая коррозия зачастую вызвана неправильным хранением или неверной эксплуатацией.
- Вторая причина возникновения коррозии – химическая. Химическая коррозия возникает как правило при соприкосновении с сухими газовыми соединениям или солями. Например, когда дорогу посыпают солью зимой, в надежде защитить автомобили от скольжения. В таком случае детали авто покрываются солями натрия и калия, которые в итоге разъедают металл. Она неприятна тем, что ей подвержены абсолютно все металлы.
- Ну и последняя причина разрушения металлов – это биологическая. То есть металлы разрушаются под воздействием микроорганизмов, радиоактивных излучений. По-другому биологическая коррозия еще называется биокоррозией.
Как же избежать неприятных последствий коррозии металла? Существует множество способов борьбы с коррозией, но самыми эффективными считаются превентивные меры – когда вы заблаговременно покрываете металл специальными антикоррозийными растворами.
Органические покрытия против коррозии
Наиболее удачно решение по борьбе с коррозией – органические смеси для предотвращения ржавчины. Преимуществами органических покрытий можно назвать простоту нанесения, разнообразие дизайнов, легкость восстановления испорченного покрытия и приемлемая стоимость. Однако, недостатком органических растворов является их неустойчивость к нагреванию. Среди органических антикоррозийных растворов выделяют:
- лаки;
- краски;
- эмали;
- пластификаторы;
- пленкообразователи.
Стоит отметить, что большую роль в успешной антикоррозийной защите играет качество смеси (то есть лака, краски или эмали), которой вы покрываете металл. От ее состава напрямую зависит, сколько прослужит металл. Правильное соотношение краски, смягчителя, катализаторов и других компонентов напрямую влияет на долговечность защиты.
Другими важными факторами являются:
- качество подготовки поверхности;
- метод нанесения;
- толщина покрытия.
Зачастую эффективнее и выгоднее воспользоваться услугами профессионалов, если необходимо защитить дорогостоящее металлическое оборудование. На производстве специалисты обладают возможностями, гарантирующими долгосрочную и качественную защиту металла от ржавчины:
- химическая обработка металлов;
- погружение в расплав;
- напыление;
- электролитическое осаждение;
- гуммирование;
- покрытие смазками и пастами;
- покрытие смолами и пластмассами.
Неорганические покрытия против коррозии
К неорганическим антикоррозийным покрытиям относятся следующие методы:
- Оксидирование металла. Этот процесс применяется в современном производстве для защиты металлов от атмосферных факторов. В процессе работы детали погружают в щелочные смеси.
- Анодирование металла. Применяется в основном для защиты алюминия и алюминий содержащих сплавов путем покрытия их антикоррозийной пленкой.
- Фосфатирование металла. Применяется для черных и цветных металлов, путем погружения в фосфорно-соляной раствор.
Применение неорганических методов борьбы с ржавчиной, в отличие от покрытия эмалями и лаками, используется в узких областях промышленности.
Подводя итоги, можно сделать определенный вывод. Для бытового использования больше подходит использование органических антикоррозийных покрытий, так как применение неорганических покрытий по большей части невозможно в домашних условиях. Кроме того, хорошее покрытие не может быть дешевым и при принятии решения самостоятельность заниматься мерами по предотвращению коррозии и гниения, стоит понимать, что в таком случае оно не будет таким долговечным, как если вы сделаете это в специально предназначенной мастерской.
Коррозия металла — причины возникновения и методы защиты
Словосочетания «коррозия металла» заключает в себе намного больше, чем название популярной рок-группы. Коррозия безвозвратно разрушает металл, превращая его в труху: из всего, произведенного в мире железа, 10% полностью разрушится в этот же год. Ситуация с российским металлом выглядит примерно так — весь металл, выплавленный за год в каждой шестой доменной печи нашей страны, становится ржавой трухой еще до конца года.
- Что такое коррозия металлов
- Химическая коррозия
- Электрохимическая коррозия
- Другие причины коррозии металла
- Меры защиты металлов от коррозии
- Антикоррозийная защита неметаллическими покрытиями
- Защита железа от коррозии покрытиями из других металлов
- Повышение коррозийной стойкости путем добавления в стальные сплавы легирующих добавок
- Меры противодействия электрохимической коррозии
- Защита от блуждающих токов

Выражение «обходится в копеечку» в отношении коррозии металла более чем верно — ежегодный ущерб, приносимый коррозией, составляет не менее 4% годового дохода любой развитой страны, а в России сумма ущерба исчисляется десятизначной цифрой. Так что же вызывает коррозийные процессы металлов и как с ними бороться?
Что такое коррозия металлов
Разрушение металлов в результате электрохимического (растворение во влагосодержащей воздушной или водной среде — электролите) или химического (образование соединений металлов с химическими агентами высокой агрессии) взаимодействия с внешней средой. Коррозийный процесс в металлах может развиться лишь в некоторых участках поверхности (местная коррозия), охватить всю поверхность (равномерная коррозия), или же разрушать металл по границам зерен (межкристаллитная коррозия).
Металл под воздействием кислорода и воды становится рыхлым светло-коричневым порошком, больше известным как ржавчина (Fе2O3·H2О).
Химическая коррозия
Этот процесс происходит в средах, не являющихся проводниками электрического тока (сухие газы, органические жидкости — нефтепродукты, спирты и др.), причем интенсивность коррозии возрастает с повышением температуры — в результате на поверхности металлов образуется оксидная пленка.
Химической коррозии подвержены абсолютно все металлы — и черные, и цветные. Активные цветные металлы (например — алюминий) под воздействием коррозии покрываются оксидной пленкой, препятствующей глубокому окислению и защищающей металл. А такой мало активный металл, как медь, под воздействием влаги воздуха приобретает зеленоватый налет — патину. Причем оксидная пленка защищает металл от коррозии не во всех случаях — только если кристаллохимическая структура образовавшейся пленки сообразна строению металла, в противном случае — пленка ничем не поможет.

Сплавы подвержены другому типу коррозии: некоторые элементы сплавов не окисляются, а восстанавливаются (например, в сочетании высокой температуры и давления в сталях происходит восстановление водородом карбидов), при этом сплавы полностью утрачивают необходимые характеристики.
Электрохимическая коррозия
Процесс электрохимической коррозии не нуждается в обязательном погружении металла в электролит — достаточно тонкой электролитической пленки на его поверхности (часто электролитические растворы пропитывают среду, окружающую металл (бетон, почву и т.д.)). Наиболее распространенной причиной электрохимической коррозии является повсеместное применение бытовой и технической солей (хлориды натрия и калия) для устранения льда и снега на дорогах в зимний период — особенно страдают автомашины и подземные коммуникации (по статистике, ежегодные потери в США от использования солей в зимний период составляют 2,5 млрд. долларов).
Происходит следующее: металлы (сплавы) утрачивают часть атомов (они переходят в электролитический раствор в виде ионов), электроны, замещающие утраченные атомы, заряжают металл отрицательным зарядом, в то время как электролит имеет положительный заряд. Образуется гальваническая пара: металл разрушается, постепенно все его частицы становятся частью раствора. Электрохимическую коррозию могут вызывать блуждающие токи, возникающие при утечке из электрической цепи части тока в водные растворы или в почву и оттуда — в конструкции из металла. В тех местах, где блуждающие токи выходят из металлоконструкций обратно в воду или в почву, происходит разрушение металлов. Особенно часто блуждающие токи возникают в местах движения наземного электротранспорта (например, трамваев и ж/д локомотивов на электрической тяге). Всего за год блуждающие токи силой в 1А способны растворить железа — 9,1 кг, цинка — 10,7 кг, свинца — 33,4 кг.
Другие причины коррозии металла
Развитию коррозийных процессов способствуют радиация, продукты жизнедеятельности микроорганизмов и бактерий. Коррозия, вызываемая морскими микроорганизмами, наносит ущерб днищам морских судов, а коррозийные процессы, вызванные бактериями, даже имеют собственное название — биокоррозия.

Совокупность воздействия механических напряжений и внешней среды многократно ускоряет коррозию металлов — снижается их термоустойчивость, повреждаются поверхностные оксидные пленки, а в тех местах, где появляются неоднородности и трещины, активируется электрохимическая коррозия.
Меры защиты металлов от коррозии
Неизбежными последствиями технического прогресса является загрязнение нашей среды обитания — процесс, ускоряющий коррозию металлов, поскольку внешняя окружающая среда проявляет к ним все большую агрессию. Каких-либо способов полностью исключить коррозийное разрушение металлов не существует, все, что можно сделать, это максимально замедлить этот процесс.
Для минимизации разрушения металлов можно сделать следующее: снизить агрессию среды, окружающей металлическое изделие; повысить устойчивость металла к коррозии; исключить взаимодействие между металлом и веществами из внешней среды, проявляющими агрессию.
Человечеством за тысячи лет испробованы многие способы защиты металлических изделий от химической коррозии, некоторые из них применяются по сей день: покрытие жиром или маслом, другими металлами, коррозирующими в меньшей степени (самый древний метод, которому уже более 2 тыс. лет — лужение (покрытие оловом)).
Антикоррозийная защита неметаллическими покрытиями
Неметаллические покрытия — краски (алкидные, масляные и эмали), лаки (синтетические, битумные и дегтевые) и полимеры образуют защитную пленку на поверхности металлов, исключающую (при своей целостности) контакт с внешней средой и влагой.
Применение красок и лаков выгодно тем, что наносить эти защитные покрытия можно непосредственно на монтажной и строительной площадке. Методы нанесения лакокрасочных материалов просты и поддаются механизации, восстановить поврежденные покрытия можно «на месте» — во время эксплуатации, эти материалы имеют сравнительно низкую стоимость и их расход на единицу площади невелик. Однако их эффективность зависит от соблюдения нескольких условий: соответствие климатическим условиям, в которых будет эксплуатироваться металлическая конструкция; необходимость применения исключительно качественных лакокрасочных материалов; неукоснительное следование технологии нанесения на металлические поверхности. Лакокрасочные материалы лучше всего наносить несколькими слоями — их количество обеспечит лучшую защиту от атмосферного воздействия на металлическую поверхность.

В роли защитных покрытий от коррозии могут выступать полимеры — эпоксидные смолы и полистирол, поливинилхлорид и полиэтилен. В строительных работах закладные детали из железобетона покрываются обмазками из смеси цемента и перхлорвинила, цемента и полистирола.
Защита железа от коррозии покрытиями из других металлов
Существует два типа металлических покрытий-ингибиторов — протекторные (покрытия цинком, алюминием и кадмием) и коррозионностойкие (покрытия серебром, медью, никелем, хромом и свинцом). Ингибиторы наносятся химическим способом: первая группа металлов имеет большую электроотрицательность по отношению к железу, вторая — большую электроположительность. Наибольшее распространение в нашем обиходе получили металлические покрытия железа оловом (белая жесть, из нее производят консервные банки) и цинком (оцинкованное железо — кровельное покрытие), получаемые путем протягивания листового железа через расплав одного из этих металлов.
Часто цинкованию подвергаются чугунная и стальная арматура, а также водопроводные трубы — эта операция существенно повышает их стойкость к коррозии, но только в холодной воде (при проводе горячей воды оцинкованные трубы изнашиваются быстрее неоцинкованных). Несмотря на эффективность цинкования, оно не дает идеальной защиты — цинковое покрытие часто содержит трещины, для устранения которых требуется предварительное никелерование металлических поверхностей (покрытие никелем). Цинковые покрытия не позволяют наносить на них лакокрасочные материалы — нет устойчивого покрытия.
Лучшее решение для антикоррозийной защиты — алюминиевое покрытие. Этот металл имеет меньший удельный вес, а значит — меньше расходуется, алюминированные поверхности можно окрашивать и слой лакокрасочного покрытия будет устойчив. Кроме того, алюминиевое покрытие по сравнению с оцинкованным покрытием обладает большей стойкостью в агрессивных средах. Алюминирование слабо распространено из-за сложности нанесения этого покрытия на металлический лист — алюминий в расплавленном состоянии проявляет высокую агрессию к другим металлам (по этой причине расплав алюминия нельзя содержать в стальной ванне). Возможно, эта проблема будет полностью решена в самое ближайшее время — оригинальный способ выполнения алюминирования найден российскими учеными. Суть разработки заключается в том, чтобы не погружать стальной лист в расплав алюминия, а поднять жидкий алюминий к стальному листу.
Повышение коррозийной стойкости путем добавления в стальные сплавы легирующих добавок
Введение в стальной сплав хрома, титана, марганца, никеля и меди позволяет получить легированную сталь с высокими антикоррозийными свойствами. Особенную стойкость стальному сплаву придает большая доля хрома, благодаря которому на поверхности конструкций образуется оксидная пленка большой плотности. Введение в состав низколегированных и углеродистых сталей меди (от 0,2% до 0,5%) позволяет повысить их коррозийную устойчивость в 1,5-2 раза. Легирующие добавки вводятся в состав стали с соблюдением правила Таммана: высокая коррозийная устойчивость достигается, когда на восемь атомов железа приходится один атом легирующего металла.
Меры противодействия электрохимической коррозии
Для ее снижения необходимо понизить коррозийную активность среды посредством введения неметаллических ингибиторов и уменьшить количество компонентов, способных начать электрохимическую реакцию. Таким способом будет понижение кислотности почв и водных растворов, контактирующих с металлами. Для снижения коррозии железа (его сплавов), а также латуни, меди, свинца и цинка из водных растворов необходимо удалить диоксид углерода и кислород. В электроэнергетической отрасли проводится удаление из воды хлоридов, способных повлиять на локальную коррозию. С помощью известкования почвы можно снизить ее кислотность.
Защита от блуждающих токов
Снизить электрокоррозию подземных коммуникаций и заглубленных металлоконструкций возможно при соблюдении нескольких правил:
- участок конструкции, служащий источником блуждающего тока, необходимо соединить металлическим проводником с рельсом трамвайной дороги;
- трассы теплосетей должны размещаться на максимальном удалении от рельсовых дорог, по которым передвигается электротранспорт, свести к минимуму число их пересечений;
- применение электроизоляционных трубных опор для повышения переходного сопротивления между грунтом и трубопроводами;
- на вводах к объектам (потенциальным источникам блуждающих токов) необходима установка изолирующих фланцев;
- на фланцевой арматуре и сальниковых компенсаторах устанавливать токопроводящие продольные перемычки — для наращивания продольной электропроводимости на защищаемом отрезке трубопроводов;
- чтобы выровнять потенциалы трубопроводов, расположенных параллельно, необходимо установить поперечные электроперемычки на смежных участках.
Защита металлических объектов, снабженных изоляцией, а также стальных конструкций небольшого размера выполняется с помощью протектора, выполняющего функцию анода. Материалом для протектора служит один из активных металлов (цинк, магний, алюминий и их сплавы) — он принимает на себя большую часть электрохимической коррозии, разрушаясь и сохраняя главную конструкцию. Один анод из магния, к примеру, обеспечивает защиту 8 км трубопровода.